Вакцины против Covid-19. Самое свежее. Эксклюзив
11.09.2021Начало тут
Характеристики вакцины от COVID-19
Предыдущие исследования, проведенные ранее для SARS-CoV и MERS-CoV помогли в поиске многообещающих антигенов для индукции нейтрализующих антител против SARS-CoV-2 [114]. Например, вакцины против SARS и MERS с использованием субъединиц S1, RBD и S2 показали высокие титры нейтрализующих антител [243]. После идентификации желаемого антигена, последовательность производственного процесса и способы доставки, а также дополнительные компоненты должны быть выбраны для эффективной и безопасной вакцинации. В дополнении к доступности расшифрованного вирусного генома и всей структурной информации SARS-CoV-2 [244], наиболее передовая технология производства вакцины может ускорить разработку вакцины и ее клиническое использование [32]. В качестве альтернативы традиционному введению антигена, новые высокотехнологичные наноплатформы способны нести широкий спектр антигенных группировок для доставки вакцины, сочетая при этом гибкость для дальнейших физических или химических модификаций [245]. Наноразмерные материалы из природных или синтетических источников могут быть сконструированы для желаемого размера, пути введения и адресной доставки к иммунным клеткам (например APC) в достижения как адаптивных, так и врожденных иммунных ответов [246]. Вакцины против COVID-19 разрабатываются в форме белков и субъединиц SARS-CoV-2, нуклеиновых кислот, кодирующих вирусный антиген, живых аттенуированных и инактивированных вирусов, реплицирующихся и нереплицирующихся вирусных векторов, вирусоподобных частиц и вакцин на основе клеток (Таблица 2). Иммунологические свойства представленных вакцин против COVID-19 и платформ доставки перечислены в Таблица 3.
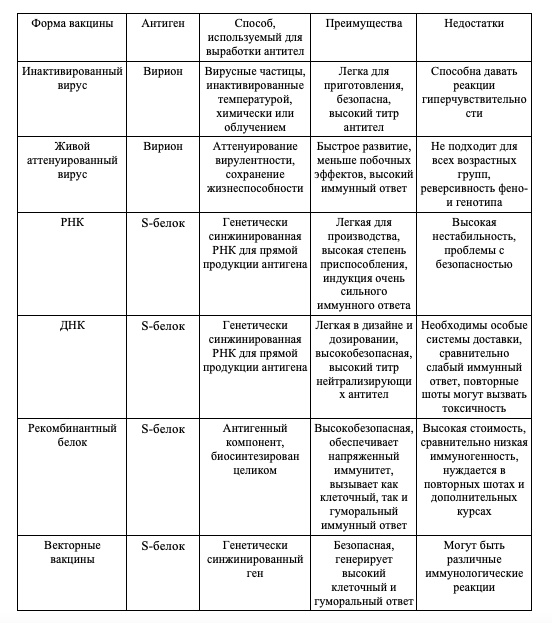
Таблица 2. Сравнения вакцинных форм, используемых для лечения COVID-19
Белковые субъединицы
Эпитопы белков S, M, N и E были проверены для определения иммунного ответа на усиление продукции антител и реакции Т-клеток против SARS-CoV-2 [247,248]. Была оценена антигенность, а также структура и функция белка S, и домен субъединицы S2 генерировал нейтрализующие антитела как против SARS-CoV, так и против SARS-CoV-2. Более ранние исследования вакцины на пациентах с SARS-CoV и MERS-CoV с использованием полноразмерных S-белков показали наличие ненейтрализующих антител, способствующих развитию ADE (antibody-dependent enhancement, антитело-зависимого усиления инфекции) и увеличению системного заражения [249-251]. Чтобы избежать образования ненейтрализующих антител, были изучены альтернативные субъединичные белковые вакцины с использованием доменов RBD, S1 и S2 [113]. Вакцины с белковой субъединицей S2 праймировали связывание и вход рецептора с противовирусным действием. Нацеливание на белок S1 и RBD предотвращало проникновение в клетки хозяина, тем самым контролируя вирусную инфекцию [225]. Белковые субъединицы обладают ограниченной иммуногенностью и требуют адъювантов для выработки нейтрализующих антител. Независимо от того, нацелено ли воздействие на полноразмерный S-белок или на его субъединицы, усиливается как человеческий, так и клеточный иммунитет, включая образование нейтрализующих антител [252]. Кроме того, белок N также считался многообещающим вакцинным материалом, поскольку он высоко иммуногенен и обильно экспрессируется в SARS-CoV-2 [253]. Т-клеточный ответ против белков субъединиц S, M и N оказался наиболее доминирующим и продолжительным при SARS-CoV-2 [205], а их субъединичные вакцины широко исследуются в клинических испытаниях [254]. Вакцины с тримерной S-субъединицей SARS-CoV-2 могут быть быстро получены путем экспрессии в клетках млекопитающих и напоминают нативный тримерный вирусный S-белок [255], а другая субъединичная частица белка S, использующая технологию молекулярного зажима, проходит клинические испытания [256] (NCT04495933). Мощные антигенспецифические ответы антител вызывались в течение 2 недель после иммунизации пластырем с микроиглами для доставки субъединиц S1 [257].
Нуклеиновые кислоты
Поскольку была обнаружена способность вызывать иммунный ответ после инъекции «голой» плазмидной ДНК, во многих клинических испытаниях использовались нуклеиновые кислоты для вакцинации против различных заболеваний, включая инфекционные заболевания и рак [258,259]. Нуклеиновые кислоты являются привлекательными кандидатами в вакцины, поскольку они относительно просты в производстве, безопасны в применении и способны генерировать высокую иммуногенность [260,261].
ДНК-вакцины легко производятся в больших количествах, обычно они состоят из плазмидного вектора, кодирующего целевую молекулу вакцины, и способны стимулировать долгосрочный гуморальный и клеточный иммунитет [262]. ДНК также стабильна и не требует хранения в холодильнике, в отличие от обычных белковых/ пептидных или цельновирусных вакцин [263].
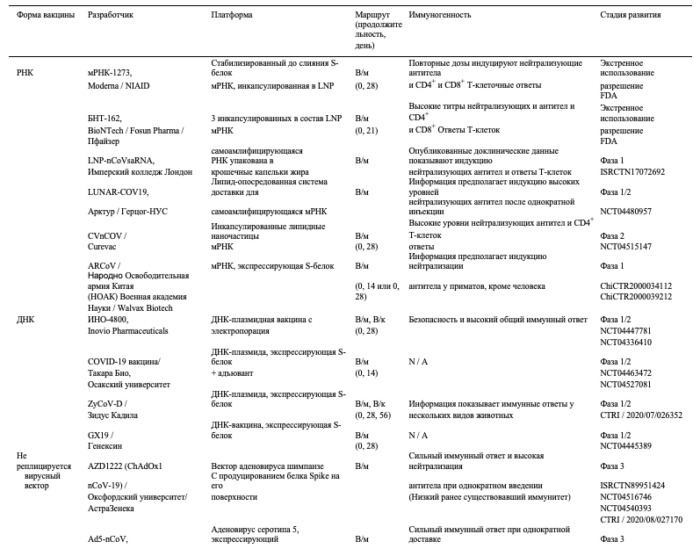
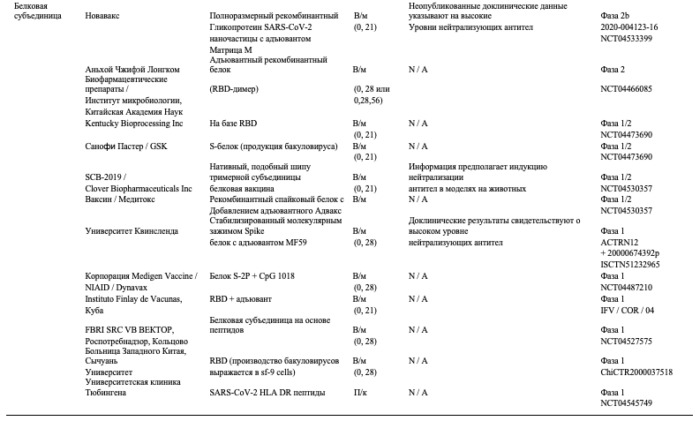
Таблица 3. Вакцины COVID-19 в разработке

Повсеместное присутствие ферментов РНКазы и их структурные различия обусловливают больший период полужизни ДНК в сравнении с мРНК, но ДНК все еще необходимо проникнуть в ядро для транскрипции, что может привести к интеграции в геном и ее дальнейшее мутирование [264]. Плазмидные ДНК-вакцины не вызывают соответствующего иммунного ответа, что требует многократных вакцинаций или использования адъюванта, который способствует усилению адаптивного иммунного ответа [265]. После экспрессии трансгена антиген презентирующая система (APC) представляет антигенные пептиды на своих рецепторах MHC I и II (главного комплекса гистосовместимости) для праймирования Т-клеток для инициации гуморального и клеточного иммунитета. Плазмидные ДНК-вакцины, экспрессирующие белок SARS-CoV-2 S, генерировали нейтрализующие антитела и антиген-специфические CD8+ Т-клетки в экспериментах у мышей и морских свинок [266], также известно, что две повторные инъекции успешно защитили макак-резус от COVID-19 [267]. Дополнительные ДНК-плазмидные вакцины, экспрессирующие S-белок, также проходят фазы I / II клинических испытаний (CTRI / 2020/07/026352 и NCT04445389) в дополнение к линейной ДНК-вакцине против S-белка, которую вводят совместно с квасцовым адъювантом ( N2CT04463472, NCT04527081).
В отличие от более ранних исследований с использованием ДНК, недавние исследования изучали использование мРНК, кодирующей S-антиген, для вакцинации [268]. мРНК вакцин необходимо доставить в цитоплазму клетки-хозяина для дальнейшей их трансляции и использования по антигенным белкам-мишеням. Вакцины на основе мРНК являются многообещающей альтернативой обычным белковым или цельновирусным вакцинам, благодаря их безопасности, высокой эффективности для создания иммунного ответа, а также быстрому и дешевому производству [261]. Однако нестабильность и неэффективность in vivo доставки — это препятствия, требующие дальнейшей доработки и улучшения, а различные модификации и способы доставки нацелены на увеличение периода полужизни in vivo и более уверенную трансляцию антигена [269-271]. Дополнительным препятствием для ДНК- и мРНК-вакцин является проникновение в клетки-мишени. Улучшение доставки нуклеиновых кислот увеличило потенциал вакцин на основе нуклеиновых кислот для повышения иммуногенности [261,272]. Для успешного проникновения через липидную мембрану применялись различные методы, в том числе физические [273,274], доставка катионных пептидов [275], доставка на основе липидов и полимеров [276,277]. Липидные наночастицы (LNP) стали одним из наиболее подходящих инструментов для доставки мРНК, состоящего из четырех основных компонентов: ионизируемого катионного липида, липид-связанного полиэтиленгликоля (ПЭГ), холестерина и встречающихся в природе фосфолипидов. В клиническом испытании 45 взрослых в возрасте от 18 до 50 лет, которые были вакцинированы префузионной стабилизированной мРНК, кодирующей S-белок, инкапсулированной в LNP, с последующей бустерной вакцинацией через 4 недели, уверенно генерировались нейтрализующие антитела против псевдотипированного репортера лентивируса и SARS-CoV-2 дикого типа [268]. Кроме того, SARS-CoV-2 специфичные CD4+ Т-клетки были обнаружены уже при использовании дозировок 25 и 100 μг, в то время как CD8+ Т-клетки были обнаружены лишь у групы, которым вводилась доза 100μг. Серьезных побочных эффектов не было, но некоторые пациенты сообщали об утомляемости, ознобе, головной боли, миалгии и боли в месте инъекции [268]. Фаза I/II клинических испытаний аналогичных вакцин, состоящих из нуклеозидной мРНК, кодирующей домен RBD или полноразмерный белок S (NCT04449276, ISRCTN17072692, NCT04480957, NCT04368728), позволила получить высокую иммуногенность с сильными CD4+Т- и CD8+Т-клеточными ответами [278], и аналогичные обнадеживающие результаты наблюдались также при введении мышам и макакам-резус [279]. Предварительные результаты III фазы клинических исследований мРНК вакцин заявлены как эффективные с точки зрения предотвращения заражения COVID-19 на 95% [280] и 94,5% [281]. Недавно Pfizer/BioNTech’s BNT162b2 стала первой вакциной на основе мРНК, которая будет разрешена для экстренного использования в Великобритании с 2 декабря 2020 г [282], а в США соответственно — с 11 декабря 2020 г [283, 284] и уже применяется у некоторых особо важных социальных групп. Дополнительные вакцинные платформы на основе мРНК были разработаны с беспрецедентной скоростью и проверены на иммуногенность и эффективность [285,286]. Один из самых больших недостатков антиковидной вакцины Pfizer/BioNTech’s заключается в том, что она предназначена для длительного хранения при температуре −70°C, что означает значительные сложности с дистрибуцией. Несмотря на препятствия, связанные с жестким температурным режимом хранения, мРНК-вакцины от COVID-19 могут помочь смягчить глобальный кризис в области здравоохранения и обеспечить оптимистичное будущее для применения мРНК для предотвращения инфекционных заболеваний в будущем.
Живые аттенуированные и цельные инактивированные вирусы
Традиционная иммунизация против вирусных инфекций основана на использовании всего патогена в ослабленном или инактивированном состоянии посредством его химических или физических изменений. Что исторически привело ко многим клинически успешным программам вакцинации наиболее иммуногенными вакцинами [287]. Хотя известно, что вакцинотерапия эффективна, риск возможных мутаций, приводящих к усилению вирулентности вируса и его реактивации у лиц с ослабленным иммунитетом, является фактором риска, который следует учитывать [288]. Исследования показали, что изменение кодона в вирусном геноме может уменьшить реверсию вирулентности, хотя это и не применимо ко всем вирусам [289]. Коронавирусы содержат неструктурные белки, которые не требуются для репликации и могут быть изменены, что приведет к ослаблению вируса in vivo. Например, делеция белков E использовалась в качестве стратегии ослабления некоторых зоонозных коронавирусов [288,290,291]. Технология расширения кода синтетического генома (GCE) для сайт-специфичного включения неприродных аминокислот в белки [292,293] позволяла синтезировать высокопродуктивные и генетически стабильные вирусы со способностью вызывать устойчивый противовирусный ответ против БВРС-КоВ, что было также применено к вирусным фрагментам SARS-CoV-2 [294,295]. Несколько живых аттенуированных вирусных вакцин, включая вакцину на основе RSV-платформы [296], проходят доклинические исследования.
Инактивированные вирусы успешно применялись против полиомиелита, гепатита А и гриппа [297]. Они могут быть быстро синтезированы путем распространения вирусов в клеточных культурах, таких как клетки Vero, с последующей тепловой или химической инактивацией с использованием формальдегида или бета-пропиолактона [298]. Они неспособны к репликации из-за разрушенной РНК и более безопасны, чем живые аттенуированные вирусы, при этом они экспрессируют вирусные эпитопы, которые могут вызывать ответную продукцию антител в организме хозяина [299]. Однако неспособность к репликации снижает иммуногенность инактивированных вирусов и требует многократных инъекций вместе с адъювантами для формирования устойчивого иммунитета [300]. В настоящее время существует шесть вакцин-кандидатов, использующих инактивированные вирусы, а еще восемь кандидатов проходят доклинические исследования [254]. Очищенный инактивированный SARS-CoV-2, введенный с квасцовым адъювантом, защищал макак-резус от COVID-19 за счет снижения вирусных титров и увеличения нейтрализующих антител против белков S и N [301]. Другая генетически стабильная инактивированная вакцина против SARS-CoV-2 была успешно произведена в экспериментальном масштабе и вызвала продукцию высоких титров нейтрализующих антител в различных моделях животных после иммунизации в 0-й и 14-й дни в дозировке на 2μг/доза [298]. Хотя инактивированные вирусы могут продуцировать нейтрализующие антитела, необходимо дальнейшее ограничение долговременного иммунитета и безопасности, поскольку предыдущие клинические исследования с инактивированными вакцинами против SARS-CoV и RSV сообщали о возникновении специфического осложнения: эозинофилии легких [302,303].
Рекомбинантные вирусные векторы
Рекомбинантные вирусные векторы разработаны для экспрессии антигенов патогенов-мишеней, и доступно множество различных типов вирусных векторов [304]. Обширные знания о функциях рекомбинантных вирусных векторов как иммуногенов указывают на их универсальность в качестве платформ для построения вакцин-кандидатов [305]. Вирусные векторы были сконструированы для доставки одного или нескольких выбранных антигенов, и способность загружать относительно большой геном все еще дает надежду на разработку относительно большого разнообразия вакцин против SARS-CoV-2 [306]. Доставка антигена-мишени с помощью рекомбинантных вирусных векторов продуцирует мощный антигенный ответ, имитирующий естественное инфицирование, с той целью, чтобы потенциально иметь возможность вызывать сильные иммунологические ответы Т-клеток без необходимости в адъюванте [307]. Быстрое производство дополнительно делает рекомбинантные вирусные векторы популярной платформой для доставки вакцин [304]. Однако необходимо учитывать некоторые аспекты дизайна рекомбинантных вирусных векторов, такие как потенциальная интеграция в геном хозяина или случайные репликации [308]. Нереплицирующиеся вирусные векторы основаны на аденовирусе типа 5 (Ad5), и большинство этих вакцин экспрессируют белок S или субъединицу RBD SARS-CoV-2 [309]. Однако у людей могут быть уже существующие антиаденовирусные антитела, поэтому альтернативный вектор, вектор аденовируса шимпанзе (ChAd) с низкой распространенностью среди людей, был использован в качестве платформы для проектирования вакцины [310,311].
Ad5, кодирующий белок S, который был разработан для выработки нейтрализующих антител при внутримышечной инъекции, вызывал токсичность в высокой дозе, а низкая доза была дополнительно оценена в клинических испытаниях фазы II [309,312]. Предыдущие клинические испытания фазы II той же вирусной платформы для вакцины против Эболы показали высокие начальные уровни нейтрализующих антител, но с быстро снижающимся титром антител [313]. Большинство добровольцев в исследовании вакцины против Эболы показали уже существующий иммунитет против Ad5, что снижает иммуногенность вакцины [314]. Ad26, кодирующий S-белок, продемонстрировал устойчивые уровни нейтрализующих антител, поскольку его ранее существовавший иммунитет был ниже, чем у Ad5 [223]. Эта система вакцины показала свою эффективность для вакцинации против ВИЧ и Эболы у нечеловекообразных приматов и людей соответственно [315,316].
ChAd, экспрессирующий S-белок, является одной из наиболее клинически продвинутых вакцин против COVID-19. Люди имеют низкий предсуществующий иммунитет к вирусному остову ChAd [316] и предыдущие исследования MERS [317] и противотуберкулезной вакцины [318] способствовал образованию нейтрализующих антител с высоким титром. При вакцинации против SARS-CoV-2 высокие уровни нейтрализующих антител [319] были обнаружены после однократной вакцинации в дополнение к ответам Т-клеток [319]. Дополнительные вакцины против новой инфекции COVID-19 разрабатываются на основе вируса кори, вируса парагриппа 5, вируса бешенства и аденоассоциированного вируса (AAV) [254].
Вирусоподобные частицы
Вирусоподобные частицы (VLP) образуются путем рекомбинантной экспрессии структурных белков. Успешные вакцины, использующие эту платформу, включают вакцины против гепатита В и вируса папилломы человека [320,321]. VLP очень стабильны, легко масштабируются для производства и безопасны [322]. VLP структурно идентичны вирусу, но не имеют вирусного генома и не заразны. VLP SARS-CoV-2 содержат белок S на поверхности, что позволяет выполнить слияние частиц с клетками-хозяевами через рецептор ACE2 и праймирование с использованием TMPRSS2, но в отличии от субъединичных вакцин, VLP не способны напрямую связываться с рецепторами B-клеток для продукции антител. [323]. VLP SARS-CoV-2, полученные путем экспрессии желаемых генов в клетках млекопитающих, сохраняют структурные и морфологические свойства вируса, что делает VLP многообещающим кандидатом на вакцину и мощным инструментом для исследований в понимании механизма SARS-CoV-2 [108]. Предполагается, что VLP SARS-CoV-2, полученные из растений, созданных с помощью генной инженерии, способны генерировать нейтрализующие антитела [324] и проходят фазу I клинических испытаний (NCT04450004). VLP, состоящие из поверхностного антигена гепатита B, дополнительно сконструированные для переноса белка SARS-CoV-2 S на поверхность, проходят фазу I клинических испытаний (ACTRN12620000817943).
Клеточные вакцины
Перепрограммирование иммунной системы против инфекционных заболеваний и рака с использованием сконструированных клеток показало клинические перспективы в последние годы, и дендритные клетки представляют собой особенно интересную иммунотерапевтическую мишень, учитывая их способность поглощать и презентовать антиген с помощью различных механизмов и основных эффективных эффекторных реакций [325]. Помимо прямого представления антигена, дендритные клетки характеризуются тем, что мигрируют между лимфоидными и нелимфоидными тканями и модулируют цитокины для длительного иммунологического воздействия [326]. Клеточная терапия применялась к вакцинам против COVID-19. В одном примере «синтетический мини-ген» экспрессирующий протеазы S, M, E, N и полипротеин протеазы (Р) SARS-CoV-2 был сконструирован с использованием лентивирусного вектора (LV-SMENP, разработан Shenzhen Geno-Immune Medical Institute) и доставлен в искусственные антиген-презентирующие клетки (aAPC) (NCT04276896). Первичным результатом этого подхода было создание иммунного ответа против SARS-CoV-2. Кроме того, LV-SMENP дендритные клетки из того же института далее модифицировали для экспрессии вирусных антигенов, которые могут активировать цитотоксические Т-клетки ex vivo (NCT04299724). AV-COVID-19 от Aivita Biomedical Inc. использует аутологичные дендритные клетки, наполненные антигенами SARS-CoV-2, и проходит фазу I клинических испытаний (NCT04386252). Однако создание клеточных вакцин затруднено из-за низкой производительности и высокой стоимости.
Производство вакцины, рецептура и иммуномодуляция
В настоящее время образование CD4+ Т, CD8+ Т- и В-клеток против белка SARS-CoV-2 S, по-видимому, являются наиболее осуществимой и достижимой стратегией [205]. Это белок, который оказался наиболее уникальным для вируса, напрямую способствует инфицированию клеток, лучше всего учитывает вирусные мутации с течением времени и генерирует наиболее устойчивый иммунный ответ [113,114]. Несмотря на то, что для вакцинации разрабатывается множество платформ, сложно определить, какая из них будет наиболее подходящей для вакцинации, соответствовать всем клиническим требованиям и пригодности для производства и распространения.
Молекулярные и вирусные вакцины
Нужный вирус необходимо сначала внедрить и размножить в клетках, а потом уже изолировать и очищать. Для вакцины против гриппа размножение осуществляется в оплодотворенных куриных яйцах [327]. Однако SARS-CoV-2 не реплицируется в куриных яйцах [328] и требует альтернативного масштабируемого метода производства, разработка которого обычно требует больших затрат и часто специального оборудования. Инактивированные вирусные и молекулярные вакцины содержат формальдегид, используемый в процессе дезактивации, соль алюминия в качестве адъюванта для усиления иммунного ответа, консерванты, стабилизаторы и антибиотики [329]. Хотя цельные аттенуированные, инактивированные и фрагментированные SARS-CoV-2 имеют простую конструкцию, они также содержат все вирусные белки, включая второстепенные антигены, которые тратят ценное пространство «на борту» вируса-платформы-носителя на антиген-презентирующий механизм и снижают выход мощных антигенов [330]. Поэтому цельные вирусы могут быть не лучшим вариантом для вакцинации.
Обычно доставка антигена осуществляется путем введения цельных или фрагментированных частей отключенного вируса. Хотя этот подход оказался чрезвычайно эффективным для вакцинации против определенных вирусов, таких как грипп и полиомиелит [297], он не продемонстрировал такой же эффективности в воздействии на другие вирусы, такие как ВИЧ [331] и близкородственный MERS [332]. Следовательно, этот подход может оказаться неэффективным для вакцинации против COVID-19. Кроме того, несмотря на то, что клинически доказано, что этот подход безопасен, инактивированные вирусные вакцины обычно не вызывают длительного иммунитета, о чем свидетельствует необходимость введения нескольких доз с течением времени [330,333]. Когда мы вакцинируем пациентов целым вирусом, их антиген-презентирующая система может поглощать и расщеплять его на несколько антигенных пептидов, что дает наибольшую возможность вызвать иммунный ответ без риска заражения [334]. Кроме того, вирусы могут непосредственно распознаваться В-клетками для нейтрализации продукции антител. Эта платформа вакцинации также имеет дополнительные преимущества: содержит некоторые функциональные РНК, которые, как было доказано, также способствуют формированию иммунного ответа [335,336]. Поскольку активность этих вирусов ограничена, их можно назначать только людям со здоровой активной иммунной системой, что исключает маленьких детей, пожилых людей и всех, у кого есть сопутствующие заболевания или которые проходят лечение, подрывающее иммунную систему [337,338]. SARS-CoV-2 был особенно опасен для последних двух групп, что делает исключение неприемлемым. Производство SARS-CoV-2 является сложной задачей наряду с другими факторами риска, и в настоящее время изучаются альтернативные платформы вирусных вакцин. Например, рекомбинантный аденоассоциированный вирус (AAV), используемый в одобреной FDA генной терапии, оказался безопасным и неканцерогенным [339]. Антиген, кодирующий рекомбинантный аденоассоциированный вирус, может безопасно доставлять трансгены, обработанные дендритными иммунными клетками для формирования иммунного ответа T- и B-клетками, и рекомбинантный аденоассоциированный вирус, экспрессирующий RBD индуцированные SARS-CoV активные антитела, нейтрализующие белок S [340].
Вакцины с наночастицами
Разнообразные системы доставки привлекли значительное внимание, поскольку они могут быть разработаны для защиты и доставки антигена и адъюванта, а также для содействия поливалентной презентации антигена, способствуя более эффективной вакцинации с усиленным иммунным ответом [341]. Достижения в области нанотехнологий открывают большой потенциал в разработке вакцин и помогли с беспрецедентной скоростью разработать новые составы вакцин-кандидатов [32]. Носители вакцин, способные к контролируемому высвобождению, такие как полимерные матрицы и гидрогели, или недавно разработанные нанотехнологические платформы с желательными физическими, химическими и биологическими свойствами, многообещающие для адресной доставки антигенов и предотвращения передачи заболеваний.
Производство вакцин на основе наночастиц во многом зависит от выбранных материалов (полимер, белок, липиды и клеточные везикулы) и полезной нагрузки (пептид, белок, РНК, ДНК и весь вирус). В этом случае должно быть легко доступно масштабируемое количество полезной нагрузки вакцины против SARS-CoV-2. Это повлечет за собой массовое биологическое производство синтетических вирусов и S-белков, или синтеза S-белка и/или пептидов. Крупномасштабное производство полезной нагрузки вакцины с нуклеиновыми кислотами может быть более легко вопроизводимым, чем биосинтез вирусов и антигенных белков, поскольку их можно собирать из небольших партий и в процессе амплификаций [342]. Как и их молекулярные аналоги, вакцины на основе наночастиц часто требуют совместного введения или совместной инкапсуляции адъюванта для повышения эффективности стимуляции дендритных клеток. Совместная инкапсуляция гарантирует, что адъювант и антигенная нагрузка достигают мишени одновременно, что имеет решающее значение для процессинга и созревания антигенов дендритных клеток [343]. Состав вакцины с наночастицами имеет преимущество перед введением только молекулярных вакцин, потому что полезная нагрузка защищена от незрелой деградации и непреднамеренных мишеней, таких как макрофаги. Кроме того, недавний прогресс позволил получить наночастицы с желаемыми физико-химическими свойствами, включая размер, форму, растворимость, гидрофильность, гидрофобность и модификацию их поверхности, что делает их легко настраиваемыми для доставки вакцины [344,345]. Кроме того, хранение в холодильнике лиофилизированных наночастиц не требуется. Составы на основе наночастиц могут увеличивать поглощение фагоцитарными антиген-презентирующими клетками (APC), особенно когда на их поверхности встроены целевые молекулы [346]. Совместная доставка адъюванта делает APC-нацеленные наночастицы идеальными вакцинами, нацеленными на эффективное и правильное обучение Т- и В-клеток, включая высокую продукцию антител [343]. Полимерные наночастицы на основе хитозана и декстрансульфата, неорганические наночастицы, такие как AuNP, и углеродные нанотрубки уже были использованы для изготовления вакцин и вакцинации [347]. Наночастицы сополимера молочной и гликолевой кислоты (PLGA) подходят для инкапсуляции антигенов с целью контролируемого высвобождения и индуцирования пролонгированного клеточного и гуморального иммунитета [348]. LNP являются многообещающими носителями мРНК-вакцин из-за их способности эффективно доставлять полезные нагрузки в цитоплазму клетки-мишени посредством парентерального введения и впоследствии генерировать высокотитровые антитела и повышать Т-клеточный иммунитет [261].
Адъюванты
Вышеупомянутые вакцины требуют совместной доставки адъювантов для надлежащей иммуностимуляции и ответа [349]. Адъюванты — это природные или синтетические материалы, которые легко распознаются иммунной системой и усиливают желаемый иммунный ответ [350]. В частности, соли алюминия используются в вакцинах более 70 лет. Адъюванты квасцов в сочетании с белком COVID-19 S продемонстрировали повышенную продукцию нейтрализующих антител [351,352], но не способствовали активации Т-клеток. Разработаны новые адъюванты для быстрой и специфической активировации иммунного ответа [352], эмульсии и агонисты толл-подобных рецепторов (TLR), как было показано, индуцируют как В-, так и Т-клеточные ответы. Полный желаемый иммунный ответ может быть достигнут путем комбинированного использования нескольких адъювантов. Все адъюванты должны сертифицированы в целях безопасности и проведения клинических испытаний, что делает использование уже одобренного адъюванта реалистичной стратегией для своевременной разработки вакцин против COVID-19 [349]. Многие современные вакцины против COVID-19, находящиеся в стадии разработки, не содержат адъювантов и способны вызывать мощный иммунный ответ самостоятельно без адъюванта [280,281,353]. Составы вакцин без адъювантов могут значительно сэкономить время на разработку и тестирование, а также затраты на производство. Однако они могут не достичь максимальной эффективности вакцины и длительного иммунитета, и большинство классических форм вакцин COVID-19, таких как инактивированные или ослабленные вирусы, вирусные фрагменты или антигенные белки или пептиды, вероятно, потребуют добавления адъювантов. [349,354]. С быстрым развитием вакцин против COVID-19 роль и необходимость адъювантов для желаемого иммунитета будут выяснены, что приведет к созданию оптимальных составов.
Вакцины на основе антиген-презентирующих клеток (APC)
Выделенные у пациентов с помощью лейкофереза дендритные иммунные клетки (ДК) используются для персонализированной клеточной терапии рака [326]. Хотя клинические испытания продемонстрировали безопасность и увеличение выживаемости таких больных, терапия ДК не принесла результатов из-за множества проблем, связанных с трудоемкостью и интенсивной подготовкой, ограниченной масштабируемостью и разницей в способности контролировать состояние созревания дендритных клеток, которое определяет, как и с какой силой реагирует иммунная система [325]. Несмотря на наличие готовых, «с полки», версий ДК, индивидуализированных для различных злокачественных заболеваний, аллогенные HLA-соответствующие ДК, которые легко доступны, терапия ДК все еще находится в стадии изучения [363]. В ДК необходимо активировать белками, пептидами или вирусами для презентации антигена вместе с соответствующей стимуляцией [364]. Если бы было доступно быстрое и надежное производство антигенных пептидов SARS-CoV-2, ДК можно было бы напрямую инкубировать с пептидами для презентации с помощью MHC I и II [365]. Иммунные клетки спроектированы с присущей им пластичностью, чтобы реагировать на сигналы микросреды и временные сигналы, что выгодно для иммунной активации. Например, вакцины COVID-19 на основе ДК могут потребовать предварительной предактивации до стабильного зрелого состояния для активной миграции в лимфатические узлы [325,366]. Кроме того, составы вакцин на основе ДК обычно отличаются значительными сложностями с точки зрения проверки качества, связанными со значительными вариациями от партии к партии, особенно до и после замораживания и оттаивания [367]. Доступ к клеточным вакцинам ограничен из-за высокой стоимости производства, строгих требований к хранению и транспортировке и ограниченной доступности [367]. Правильно сконструированные вакцины COVID-19 на основе ДК могут эффективно стимулировать В- и Т-клетки посредством активной мигрирации в лимфатические узлы, где они непосредственно представляют антигенные пептиды белка SARS-CoV-2 S MHC I и II эффекторным иммунным клеткам вместе со стимуляцией соответствующими цитокинами [365] (Рис. 6).
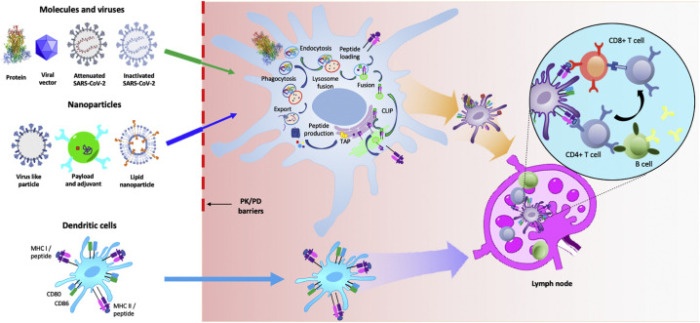
Рис. 6. Молекулярные и вирусные вакцины после инъекции действуют как депо, что требует поглощения местными клетками для презентации антигена. Вакцины из этой категории требуют прибытия антиген-презентирующей системы (например, дендритных клеток, ДК) к месту вакцинации для последующей обработки антигена и транспортировки к лимфатическим узлам. Важно отметить, что эти вакцинные композиции обычно включают адъювант для иммуностимуляции, включая желаемое созревание ДК. Составы наночастиц также сопровождают адъювант и обеспечивают совместную доставку адъюванта и презентацию полезной нагрузки вакцины к ДК, что приводит к увеличению вероятности созревания дендритных клеток и иммунизации против совместно доставляемых антигенов. Нацеливающие группы также помогают наночастицам достигать ДК. Дендритные клетки также могут быть выделены и по-новой сконструированы ex vivo для представления антигенов SARS-CoV-2 для оптимизированной презентации антигена в желаемом состоянии созревания. Хотя этот процесс трудоемкий, дорогостоящий и сложный в культуре, прямое применение антигенпрезентирующих ДК позволяет избежать фармакокинетических (PhK) и фармакодинамических (PhD) барьеров, таких как клиренс, связанный с молекулярными и вирусными вакцинами, а также этапы набора клеток, требуемые другими методами вакцинации. Активированные ДК мигрируют через лимфатические сосуды в лимфатический узел, где они могут обучать Т- и В-клетки для активного удаления инфицированных клеток и выработки антител.
Перспективы
Чтобы защитить большинство населения мира, включая группы высокого риска, более 200 кандидатов на вакцину COVID-19 находятся в стадии исследования (рисунок 1) путем адаптации ранее разработанных вакцинных платформ и применения знаний об инфекционных вирусах, включая ВИЧ, вирус гриппа, вирус Зика, лихорадку Эбола, SARS-CoV и MERS-CoV [18,217,317]. Для введения белков SARS-CoV-2 и пептидных субъединиц, а также генетических материалов, кодирующих вирусные антигены, требуются составы, отвечающие клиническим требованиям для эффективной и безопасной вакцинации. Такие как высокая стабильность в физиологических условиях, минимизация побочных эффектов и эффективное клеточное поглощение иммунными клетками-мишенями [251,297]. Потенциальными преимуществами создания вакцин COVID-19 на различных нанотехнологических платформах являются повышенная стабильность материалов вакцины при длительной иммунизации, улучшенная фармакокинетика и фармакодинамика антигенов, а также усиленный иммунный ответ за счет совместно доставляемых адъювантов. Это особенно важно при разработке новых форм нуклеиновых кислот и вакцин против COVID-19 на клеточной основе, что уже продемонстрировано текущими клиническими испытаниями [26,32]. Значительной проблемой при разработке вакцины против COVID-19 являются частые мутации в белке S вируса SARS-CoV-2, наиболее распространенном антигене-мишени в текущих усилиях. Это ограничивает эффективность вакцины COVID-19 первого поколения и даже требует вакцинации выздоровевших пациентов против новых мутантов [35,119,220]. Таким образом, идеальная вакцинная платформа против COVID-19 должна обеспечивать легкое и быстрое размещение недавно мутировавших и только что идентифицированных антигенов. Текущие продолжающиеся доклинические и клинические исследования вакцин против COVID-19 в первую очередь нацелены на выработку нейтрализующих антител против SARS-CoV-2 и, желательно, на выработку Т- и В-клеток памяти [114,204,206]. Для эффективной и долгосрочной защиты от инфекции SARS-CoV-2 требуется хорошо организованный врожденный, гуморальный и клеточный иммунитет, который может быть достигнут с помощью специфической платформы доставки вакцины. Подобная платформа в перспективе объединит несколько мощных антигенов или антиген-кодирующих нуклеиновых кислот, совместно доставляющих подходящие костимулирующие молекулы и нацеленных при этом на специфические иммунные клетки.
Воспаление является неотъемлемой частью иммунного ответа и необходимо для устранения патогенов с последующей регенерацией тканей и восстановлением гомеостаза [368]. В отличие от других инфекций, где воспалительная деятельность полезна, чрезмерное производство цитокинов / хемокинов во время инфекции SARS-CoV-2, называемое цитокиновым штормом, приводит к острому респираторному дистресс-синдрому (ОРДС) и полиорганной недостаточности [99,103]. Контроль активности цитокинов / хемокинов на ранних стадиях COVID-19 возможен с помощью иммуномодуляторов, антагонистов цитокинов и противовоспалительных средств. Сообщается, что купирование системного воспаления помогает снизить уровень смертности пациентов [76,103,369]. Комбинированная лекарственная терапия системного воспалительного ответа предполагает вероятность развития лекарственной устойчивости [370], потому вакцины COVID-19 с использованием платформы нанотехнологий способны совместно доставлять антигены и дополнительные желаемые лекарства, такие как ингибиторы протеазы, ингибиторы обратной транскриптазы (например, ремдесивир) и иммуносупрессоры (например, дексаметазон), чтобы предотвратить цитокиновый шторм [371] или «синергетически искоренить» SARS-CoV-2 до прогрессирования тяжелого заболевания (Рис. 7).

Рис. 7. Развитие клинического заболевания COVID-19 и комбинированная стратегия вакцинации и лечения для «синергетического искоренения» SARS-CoV-2, минимизации побочных эффектов и снижения смертности. В течение 1-2 дней после заражения SARS-CoV-2 локально реплицируется, и у большинства людей симптомы отсутствуют. В следующие 3-7 дней вирус продолжает распространяться в дыхательные пути и легкие с клиническими проявлениями. Воспалительные клетки выделяют высокие уровни цитокинов (например, ИЛ-6, ИЛ-1β, и IFNα), способствуя цитокиновому шторму. На более поздних стадиях инфекции у пациентов с COVID-19 возникает острый респираторный дистресс-синдром (ОРДС), полиорганная недостаточность и, в конечном итоге, наступает смерть. Большинство лечебных воздействий было сосредоточено на перепрофилировании противовирусных или антивирусных препаратов. FDA одобрили использование ремдесивира и дексаметазона для ингибирования синтеза вирусной РНК и ослабления системного воспалительного ответа соответственно. Контроль как репликации вируса, так и воспаления может помочь снизить уровень смертности пациентов, но их клиническая эффективность ограничена. Различные нанотехнологические платформы могут быть разработаны для комбинированной терапии путем доставки поливалентных антигенов и желаемых лекарств, которые могут синергетически снижать вирусную нагрузку, воспаление и исключить тяжелое течение заболевания.
Наночастицы с цитокин-связывающими свойствами подавляли цитокиновый шторм, а покрытые пегилированным декстраном супермагнитные наночастицы оксида железа (SPION) были связаны с анти-IL4Rα антителами, уменьшая экспрессию воспалительных цитокинов и восстановленная легочной ткани у мышей [372]. ACE2-экспрессирующие CD68+ CD169+ макрофаги, содержащие белок SARS-CoV-2 N, увеличивают содержание IL-6 в селезенке и лимфатических узлах [373]. Использование наночастиц, которые нацелены на внутренние воспалительные клетки, ответственные за цитокиновый шторм — это перспективный подход к развитию эффективных и безопасные вакцины против COVID-19. Недавние исследования показали, что биомиметические наноматериалы, такие как внеклеточные везикулы (EV), несущие анти-воспалительные препараты, могут сыграть значительную роль в облегчении местного синдрома высвобождения цитокинов в легочной ткани [374]. Кроме того, было обнаружено, что клеточные наногубки, экспрессирующие ACE2 и CD147, связывают и препятствуют инфицированию SARS-CoV-2 [375].
Неожиданное и драматическое появление COVID-19 потребовало немедленных действий, направленных на организацию производства вакцинных препаратов, что привело ведущих игроков к проведению продвинутых исследований и клинических испытаний стадиям замечательных темпов, необходимо провести надежную клиническую оценку потенциальных рисков и рассмотреть ее до вакцинации беспрецедентно больших групп населения [32,58,238]. Хотя все еще относительно редко, у некоторых пациентов, участвовавших в клинических испытаниях, наблюдались серьезные побочные эффекты, которые не были полностью объяснимы [376]. Появление сообществ и стран, уличенных в выпуске неэффективных или частично эффективных вакцин, может иметь тяжелые последствия, как указывает FDA в своих релизах, напоминая о наличии строгих требований к процедуре испытаний перед утверждением вакцины [377]. Преждевременное заявление могло иметь непредвиденные последствия, такие как бездоказательное использование гидроксихлорохина в лечении COVID-19, что привело к нехватке пациентов с волчанкой [378]. Эффективность и долговечность иммунитета, сформированного введением вакцин против COVID-19 неизвестна, и может потребоваться двухдозовая комплексная стратегия первичной бустерной вакцинации или периодически вводимая бустерная доза [379,380] (данная статья вышла в свет в декабре 2020 года и отражала этап создания противовирусных вакцин против SARS-CoV; сегодня, 23.08.2021, уже известно, что введение третьего бустера в разы снижает летальность. — Прим. переводчика). Предсуществующие антитела против SARS-CoV-2 или других вирусов, равно как и их перекрестная реактивность также могут играть роль в эффективности и безопасности вакцин против COVID-19 [205]. Однако лабораторное обследование на наличие антител перед вакцинацией может быть полезной, но сложной задачей.
Заключение
Уникальная и неожиданная патологическая физиология COVID-19 потребовала беспрецедентных вложений усилий и ресурсов, в особенности с точки зрения разработки эффективных и безопасных биоинженерных препаратов. Недостатки предыдущего клинического опыта с SARS-CoV и MERS-CoV были в срочном порядке компенсированы и преодолены глобальным сотрудничеством и конкуренцией между гигантами фармацевтической промышленности и исследовательскими сообществами, начиная с исторически быстрых клинических испытаний. Для достижения напряженного иммунитета и возникновения в крови надлежащего титра нейтрализующих антител сильнодействующие антигены должны быть размещены на носителях вакцин, которые предназначены не только для доставки полезных нагрузок к клеткам-мишеням вместе с соответствующей стимуляцией, но также и для решения специфических проблем вакцинации против COVID-19, таких как долгосрочный иммунитет и предотвращение цитокиновых бурь. Обширная библиотека наноматериалов, первоначально разработанных для доставки пептидов, белков, нуклеиновых кислот, вирусов и клеток обещает удовлетворить требования, предъявляемые к вакцинам против COVID-19. COVID-19 — огромная научная, клиническая и социальная проблема, в решении которой появившиеся высокотехнологичные и весьма новаторские вакцинные препараты играют решающую роль.
адаптировал Артём Машуков

