Критическая роль Т-клеток памяти при COVID-19. Эксклюзив
31.07.2021
Аннотация
Из-за своей высокой распространенности и длительного инкубационного периода, часто бессимптомного, тяжелый острый респираторный синдром SARS-CoV-2 поразил миллионы людей во всем мире, вызвав пандемию коронавирусной болезни 2019 (COVID-19). Несмотря на недавнее одобрение противовирусного препарата ремдесивира и разрешении на экстренное использование моноклональных антител против белка S, бамланивимаба и комбинации казиримаба/имдевимаба, эффективные и безопасные вакцины против COVID-19 по-прежнему отчаянно востребованы не только для предотвращения его распространения, но и для восстановления социальной и экономической деятельности путем массовой иммунизации. Недавнее разрешение на использование вакцин Pfizer и BioNTech’s с мРНК может обеспечить некоторый прогресс на этом направлении, но все еще требуется мониторинг долгосрочного иммунитета после их применения, а кроме того несколько различнывакцин-кандидатов находятся все еще в стадии разработки. По мере того, как знания о патогенезе SARS-CoV-2 и взаимодействиях с иммунной системой продолжают развиваться, продолжают изучаться и проходить клинические испытания различные лекарственные препараты-кандидаты. Потенциальные вакцины и терапевтические средства против COVID-19 включают т.н. «перепрофилированные» лекарства, моноклональные антитела, противовирусные и антигенные белки, пептиды и генно-инженерные вирусы. В этой статье рассматриваются вирусология и иммунология SARS-CoV-2, методы лечения COVID-19, альтернативные способы вакцинации, принципы и соображения дизайна при разработке вакцины против COVID-19, а также перспективы и роль способов вакцинации в решении уникальных иммунопатологических проблем, поставленных этим заболеванием.
1. Введение
Коронавирусы человека были впервые обнаружены в 1960-х годах [1], и названы в честь коронообразной структуры белков-шипов на их поверхности, которая имеет решающее значение для их патогенности. Согласно текущим базам данных нуклеотидных последовательностей, прослежена связькоронавирусов человека с соответствующими видами животного происхождения [2]. Известно, что некоторые коронавирусы, например HCoV-229E, HCoV-OC43, HCoV-NL63 и HCoV-HKU1, вызывают легкие респираторные симптомы, похожие набанальную простуду [3]. Коронавирус тяжелого острого респираторного синдрома (SARS-CoV) и коронавирус ближневосточного респираторного синдрома (MERS-CoV), которые возникли в 2002 и 2012 годах соответственно [4], являются на порядок более заразными и ответственны за опасные для жизни заболевания у младенцев, пожилых людей и пациентов с ослабленным иммунитетом.
Новый коронавирус, SARS-CoV-2, появился в декабре 2019 года в результате вспышки в китайском Ухане [5]. По данным Центра по контролю и профилактике заболеваний (CDC) США, передача вируса в основном осуществляется при прямом контакте или воздушно-капельным путем [6] на близком расстоянии и в зависимости от времени, часто требуя тесного контакта в пределах 2 метров в течение 15 минут или дольше [7]. Однако недавно была продемонстрирована возможность передачи воздушно-капельным путем при определенных обстоятельствах [8-11], включая длительное пребывание в замкнутом пространстве без надлежащей вентиляции [12-14]. Вирус быстро распространился по миру через путешественников, и число случаев заболевания во всем мире превысило 72 миллиона, при этом по состоянию на 14 декабря 2020 года погибло более одного миллиона человек [15]. Признано, что зарегистрированные числа занижают фактические случаи заражения, учитывая, что инфицированные, но бессимптомные люди вряд ли прошли тестирование, а протоколы тестирования и стандартизированные методы отчетности критически отсутствуют [16]. Генетическая последовательность SARS-CoV-2 стала доступной в течение нескольких недель после его открытия и была идентифицирована как бета-коронавирус с близким генетическим сходством с SARS-CoV [17]. Хотя SARS-CoV-2 менее опасен, чем SARS-CoV, он передается намного легче и быстрее [18], чему очень способствует длительныйбессимптомный инкубационный период. Частое отсутствие каких-либо симптомов делают идентификациюивыявление заболевших, отслеживание контактов, а также лечение этого нового заболевания неожиданно тяжелым [19]. Инкубационный период после первого контакта с инфекцией SARS-CoV-2 составляет около 2–14 дней и, вероятно, будет варьировать в зависимости от возрастной группы, а также от степени тяжести сопутствующихзаболеваний [20]. Подобно SARS-CoV и MERS-CoV, SARS-CoV-2 преимущественно поражает дыхательные пути, вызывая симптомы и заболевания, варьирующиеся от легких респираторных явлений до тяжелого острого респираторного синдрома, причем последний приводит к легочной недостаточности, а у некоторых пациентов в конечном итоге к смерти [21]. Наиболее частыми симптомами COVID-19 являются лихорадка, сухой кашель, утомляемость и одышка, тогда как тяжелые симптомы сопровождаются системной вирусемией и пневмонией [22].
За последние 100 лет вакцинынеуклонно увеличивали продолжительность жизни, коренным образом меняя общество и экономику [23]. По мере того, как вакцинация становится широко доступной и широко используемой, разрушительное воздействие многих инфекционных заболеваний ослабло [23]. Лечение многих инфекционных заболеваний обходится дорого, о чем свидетельствуют расходы на лечение обычного сезонного гриппа и ОРВИ, которые несут огромное экономическое и социальное бремя [24]. Достаточный охват широких слоев населения профилактической вакцинацией может снизить эти затраты, он же играет ключевую роль в защите людей от вирусных инфекций в условиях эпидемии [25]. Стратегии профилактики и варианты лечения COVID-19, включая плазму выздоравливающих, моноклональные антитела, «перепрофилированные» лекарства, которые уже одобрены в клинике, и различные вакцины активно изучаются с использованием достижений биологических подходов к системам доставки [26-31]. Во всем мире проводится изучение более 200 вакцин-кандидатов; однако остается неясным, как разработать безопасную и высокоиммуногенную вакцину против COVID-19. Основные вызовы в процессе разработки вакцины против COVID-19 включают вопрос в использовании подходящей технологической платформы,неспособность вакцинсгенерировать долгосрочный иммунитет и неспособность каким-то образом успокоить цитокиновый шторм. Помимо обычных инактивированных или живых аттенуированных (значительно ослабленных) вирусов, вирусных векторов и субъединичных вакцин, новые подходы к вакцинам с использованием нанотехнологий обладают высокой степенью адаптируемости и способствуют ускоренной разработке вакцин [32]. Однако большинство этих платформ еще не лицензировано для использования на людях, что вызывает вопросы о долгосрочной безопасности, а также степени, в которой они могут вызывать сильный и долговременный иммунитет [33]. Еще одна ключевая проблема — полагатьсяна т.н. «S-only» вакцины, так как мутации были обнаружены в спайке(S) белка SARS-CoV-2 [34,35] и многие вакцины-кандидаты могут нуждаться в переработке и тестировании. Согласно исторически уже сложившейся традиции идеальная вакцина состоит из антигена или нескольких антигенов, адъювантов и платформы доставки, которая может быть эффективным против целевой инфекции, безопасной для широкого популяции и способной вызывать длительный иммунитет. В этом обзоре описывается SARS-CoV-2 и связанный с ним иммунный ответ на его инфекцию, варианты лечения, разрабатываемые в клинике, обоснование и подходы к разработке вакцины против COVID-19, а также многообещающая роль систем доставки вакцины в борьбе с беспрецедентной пандемией.
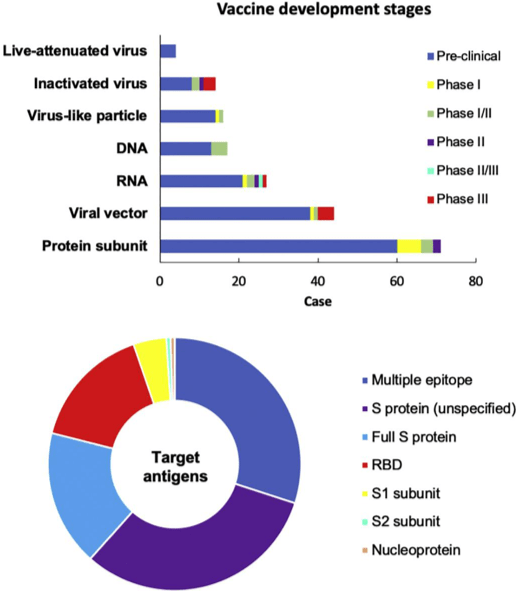
Рисунок 1. Текущие доклинические и клинические испытания вакцин против COVID-19, по данным Всемирной организации здравоохранения (ВОЗ) по состоянию на 8 декабря 2020 г. Из 214 вакцин-кандидатов 52 проходят клинические испытания, а 162 — доклинические. Ведущие вакцины-кандидаты нацелены на спайковый (S) белок SARS-CoV-2, включая субъединицу рецептор-связывающего домена (RBD), за которым следует полноразмерный S-белок.
2. Вирусология SARS-CoV-2 и вакцинация против него: краткий обзор
SARS-CoV-2 представляет собой оболочечный вирус с одноцепочечной РНК (оцРНК) с шипообразными гликопротеинами, экспрессируемыми на поверхности, образующимит.н. ’корону’. Геном SARS-CoV-2 обладает 79,6% генетической идентичности SARS-CoV и состоит из четырех ключевых белков [17,36]. Белок S обеспечивает прикрепление и проникновение SARS-CoV-2 в клетки хозяина, а белок мембраны (M) является компонентом целостности вирусной мембраны. При этом белок нуклеокапсида (N) связывается с вирусной РНК и поддерживает образование комплекса нуклеиновой кислоты и белковой оболочки, помогая отпочковыванию вируса, репликации РНК и репликации мРНК [37]. Белок оболочки (E) наименее изучен из-за его механизма действия и структуры, но, по-видимому, играет роль в сборке, высвобождении и патогенезе вируса [38] (Рис. 2). Белок S вируса связывается с рецептором ангиотензинпревращающего фермента 2 (ACE2) на поверхности клетки-хозяина, при этом дополнительно праймируя трансмембранную протеазу серина (TMPRSS2) [39-41]. TMPRSS2 расщепляет белок S на две субъединицы, S1 и S2, во время проникновения вируса в клетку-хозяин через слияние мембран. Экспрессия ACE2 повсеместно встречается в носовом эпителии, легких, сердце, почках и кишечнике, но редко имеет место в иммунных клетках [42,43]. Недавние исследования показали, что есть и другие рецепторы, участвующие в проникновении вируса в разные типы клеток. Как и в случае SARS-CoV, CD-147 на эпителиальных клетках также является рецептором для SARS-CoV-2 [44]. CD26 (дипептидилпептидаза 4, DPP4), первоначально обнаруженный во время проникновения БВРС-КоВ в клетку, и также недавно стал потенциальным рецептором для SARS-CoV-2 [45,46]. Структурный анализ показал взаимодействие белка S (на SARS-CoV-2) с CD26 клеток-хозяев [47].
Критическая роль, которую белок S играет в проникновении вируса, делает его привлекательной мишенью для производства вакцин против COVID-19 [48]. Субъединица S1 содержит в изобилии белки рецептор-связывающего домена (RBD), ответственные за связывание с ACE2, в то время как субъединица S2 содержит сайт расщепления, который имеет решающее значение для слияния вирусной и клеточной мембран [49]. Вычислительный анализ и ранее полученные знания о биологии SARS-CoV и MERS-CoV свидетельствуют о том, что полноразмерный S-белок, белки субъединиц S1, RBD и S2 являются ключевыми эпитопами для индукции нейтрализующих антител [5,50]. Несмотря на то, что белок S сходен по своей структуре у различных штаммов SARS-CoV-2, он показал в 20 раз более высокое связывание с клеткам-хозяевам, чем например аналогичный белок SARS-CoV, что объясняет высокую скорость передачи COVID-19 [4]. Белок S как в SARS-CoV, так и в SARS-CoV-2 дополнительно индуцирует слияние инфицированных и неинфицированных клеток, обеспечивая прямое распространение вируса между клетками, избегая при этом нейтрализующих вирусы антител. Возможность использования нескольких нейтрализующих эпитопов делает белок S наиболее популярной мишенью для вакцинации. В частности, эпитоп S1, содержащий как N-концевой связывающий домен (NTD), так и RBD, использовался при разработке вакцины.Антитела против домена RBD, как ранее было продемонстрировано, предотвращают заражение SARS-CoV и MERS-CoV [51,52]. Белок N — это самый распространенный белок среди коронавирусов, для которого характерен высокий уровень консерватизма. В то время как пациенты показали развитие антител против белка N [53], его значение в технологии изготовления вакцинацы остается спорным. Некоторые исследования продемонстрировали значимый N-специфичный гуморальный и клеточный иммунные ответы [54], в то время как другие показали невозможность вклада белка N в выработку нейтрализующих антител [55]. Иммунизация белком М, основным белком на поверхности SARS-CoV-2, эффективно вызывала образование нейтрализующих антител у больных SARS [56]. Структурный анализ трансмембранной части белка М показал кластер Т-клеточных эпитопов, который обеспечивает индукцию сильного клеточного иммунного ответа против SARS-CoV [57], и он также может быть полезным антигеном при разработке вакцины против SARS-CoV-2. По сравнению с белками S, N и M, белки E SARS-CoV-2 не перспективны для вакцинации, поскольку их структура и низкое количество вряд ли вызовут иммунный ответ [58].
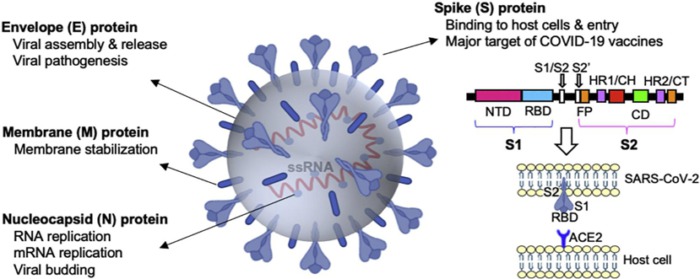
Рис. 2. Структура SARS-CoV-2 с одноцепочечной РНК, которая на 79,6% идентична последовательности SARS-CoV и кодирует белки S, M, E и N. Белок S, основнаямишень для вакцинации, содержит три критических элемента: S1, рецептор-связывающий домен (RBD) и субъединицы S2. Субъединица S1 содержит N-концевой и C-концевой поддомены (CTD), которые находятся в закрытой конформации до тех пор, пока определенные протеазы не расщепят S1/S2 и S2′ области. RBD расположен в S1-CTD и необходим для связывания с рецептором ACE2 на поверхности клеток-хозяев. Домен субъединицы S2 образует тримерную структуру и содержит слитый пептид (FP) и два гептадных повтора (HR1 и HR2), которые необходимы для слияния вирусной мембраны и мембраны хозяина. Самый распространенный белок N упаковывает геном в вирион для эффективной репликации вируса, белок M участвует в интеграции вируса, а белок E способствует сборке, формированию оболочки и почкованию.
3. Патология COVID-19 и иммунный ответ на SARS-CoV-2
Легкие ежедневно подвергаются воздействию тысяч литров воздуха, что создает огромные возможности для попадания в организм переносимых по воздуху патогенов [59]. Таким образом, иммунная система в легких очень уязвима и постоянно активна [60-62]. Слизь, защитный барьер в легких, покрывает эпителиальные слои и улавливает мелкие частицы и патогены, которые легко выводятся из организма при кашле [63]. Однако респираторные вирусы, такие как коронавирус, способны проникать через этот барьер. Вирус заражает клетки легких и вызывает иммунный ответ, рекрутируя специфические иммунные клетки, которые высвобождают воспалительные цитокины и первичные Т- и В-клетки для иммунного ответа [64]. Этот процесс предназначен для удаления вирусов; однако в некоторых случаях возникает дисфункциональный иммунный ответ, вызывающий серьезное повреждение легких и в конечном итоге приводящий к системной воспалительной реакции. Иммунный ответ хозяина на SARS-CoV-2 до сих пор полностью не изучен, несмотря на продолжающиеся исследования. Однако клинические данные, полученные с помощью SARS-CoV и MERS-CoV, несут некоторые фундаментальные знания с возможностью прогнозирования реакции иммунной системы хозяина [65].
При вдыхании эпителиальные клетки легких распознают SARS-CoV-2 как патоген через рецепторы распознавания образов (PRR) и секретируют молекулы для набора иммунных клеток, которые опосредуют врожденный и адаптивный иммунитет [66]. Перваялиния обороны — это альвеолярные макрофаги, несущие как воспалительные TLR2, 4, 6, IL-1R, IFNγ-R и TNFR, а также CD200R, SIRP, рецептор маннозы, TREM2, IL-10R и TGFBR, которые играют регуляторные роли в контроле иммунного ответа [67]. Подмножество CD103+, находящихся в дыхательных путях и легких дендритных клеток (ДК) используют свои дендритные структуры для проникновения через эпителиальный слой и захвата антигена [68,69]. Затем антиген обрабатывается для представления MHC I и MHC II в CD8+ Т и CD4+ Т-клеток соответственно [70]. CD4+ Т-клетки помогают в общем адаптивном ответе путем стимуляции В-клеток и CD8+ Т-клеток, выступая посредниками как в общем адаптивном, так и клеточном иммунном ответе, а также развитии популяций клеток памяти [71]. ДК также мигрируют в лимфатические узлы для образования наивных Т-клеток [72]. В частности, иммунный ответ типа Th1 играет доминирующую роль в адаптивном иммунном ответе на вирусные инфекции [73]. CD4+ Т-клетки быстро активируются в Т-хелперные клетки (Th1), секретирующие GM-CSF, которые активируют CD14+ CD16+ моноциты с высокой экспрессией ИЛ-6 для ускорения воспалительного ответа [74]. Клетки Th17 продуцируют IL-17 для дальнейшего рекрутирования моноцитов,макрофагов и нейтрофилов и стимулируют цитокины, включая ИЛ-1β, ИЛ-6 и ИЛ-1 среди других [75,76].
Белок SARS-CoV-2 S связывается с эпителиальными клетками носовой полости через рецепторы ACE2 [77]. При входе внутриклеточные сенсоры, TLR7 / 8 и RIG-I / MDA-5, подают сигнал для активации факторов транскрипции, IRF3 / 7 и NF-κB, и продукции интерферонов типа I (IFN) и воспалительных цитокинов [78]. IFN типа I играют критическую роль в адаптивном иммунном ответе и предотвращении распространения вируса, стимулируя другие иммунные клетки для производства воспалительных цитокинов, хемокинов и антивирусных ферментов [79,80]. Однако, как и SARS-CoV и MERS-CoV[81], SARS-CoV-2 может уклоняться от продукции интерферонов первого тип [82,83], подавляет индукцию IFN [84-88] и подавляя передачу сигналов IFN [89,90]. Недавно было доказано, что этот процесс уклонения является основным фактором, лежащим в основе развития тяжелых случаев COVID-19 [91] и может быть важной целью терапевтического вмешательства.
В течение 1-2 дней после заражения SARS-CoV-2 локально реплицируется, что позволяет обнаруживать его с помощью ПЦР в режиме реального времени путем мазка из носа [92]. Многие пациенты на этой стадии часто протекают бессимптомно, но все же очень заразны. Примечательно, что средний log10 вирусной нагрузки более 5-6 копий/мл является независимым предиктором агрессивного теченияCOVID-19 и высокой смертности [93]. В последующие 3-7 дней SARS-CoV-2 остается ограничен верхними дыхательными путями у большинства пациентов с легкими симптомами, а эти симптомы можно контролировать и лечить дома [94]. Однако у некоторых пациентов вирус продолжает распространяться по бронхиальному дереву с клиническими проявлениями [95]. Наконец, SARS-CoV-2 распространяется на зону газообмена и поражает альвеолярные клетки [93]. Затем скорость распространения вируса уменьшается по мере того, как вирус распространяется и повреждает эпителий, что способствует его концентрации на этих участках и дальнейшему проникновению в ткани. Клеточный аппарат презентирует при этом вирусные пептиды от MHC I до CD8+ Т-клетки [70], что приводит к клональной экспансии и развитию SARS-CoV-2-клеточной памяти. CD8+ Т-клетки далее способствуют выведению инфицированных клеток за счет индукции апоптоза через перфорин и гранзимы [96]. Отвечая воспалительными макрофагами, моноцитами, нейтрофилами и лимфоцитами, которые борются с вирусом [97,98]. В то же время смертельные уровни воспалительных IFNα, IFNγ, Ил-1β, ИЛ-6, ИЛ-12, ИЛ-18, ИЛ-33, TNFα, TGFβ, CCL2, CCL3, CCL5, CXCL8, CXCL9, CXCL10 и других высвобождаются, способствуя цитокиновому шторму. На поздних стадиях заражения коронавирусами, включая SARS-CoV, MERS-CoV и SARS-CoV-2, цитокиновые бури являются основной причиной прогрессирования заболевания, острого респираторного дистресс-синдрома (ОРДС), системного воспалительного ответа, полиорганной недостаточности и, в конечном итоге, приводят к смерти [99-101] (Рис. 3). Противовирусный иммунный ответ имеет решающее значение для выведения вируса на ранних стадиях инфекции, но устойчивый и стойкий иммунный ответ может привести к массивной продукции цитокинов и повреждению тканей хозяина [102,103]. Примерно 14% пациентов с COVID-19 страдают выраженной одышкой и 5% попадают в критические состояния, включая дыхательную недостаточность, септический шок, полиорганную недостаточность и шоковое состояние [95]. Первое вскрытие пациента с COVID-19 показало скопление мононуклеарных моноцитов ивоспалительных Т-клеток в легких, но с низким уровнем
активных Т-клеток против SARS-CoV-2 [97]. В особо тяжелых случаях COVID-19 наблюдались более специфические наборы клеточных популяций [104]. Пациенты показали сходные общие уровни общих активированных Т-лимфоцитов и цитотоксических Т-лимфоцитов (CTL), особенно — повышенные уровни CD4+ Т-клеток, лейкоцитов, нейтрофилов и пониженные — моноцитов, эозинофилов, базофилов, Treg, клеток иммунной памяти и CD8+ Т-клеткок [105,106]. Дополнительные исследования обнаружили повышенную концентрацию ИЛ-1.β, IFN-γ [107] и Ил-6 [108,109]. После распознавания патогенного антигена и выздоровления часть Т-клеток памяти остается в легких [110], готовые к действию при вторичном контакте или заражении. Было доказано, что резидентные Т-клетки памяти имеют решающее значение для уничтожения вируса, поскольку исследование респираторно-синцитиального вируса человека (РСВ) показало, что они могут уничтожить вирус без помощи антител [111].
Переход между врожденным и адаптивным иммунными ответами имеет решающее значение для борьбы с инфекцией SARS-CoV-2 и зависит от того как CD4+ Т-клетки взаимодействуют с В-клетками для производства специфических антител [112]. В предыдущих исследованиях сообщалось о конкретных нейтрализующих антителах против белка S [113-115]. Однако есть еще несколько вопросов относительно значимости наличия в крови антител к вирусному белку и перекрестной реактивности антител к другим распространенным коронавирусам, в частности между SARS-CoV и SARS-CoV-2, с идентичными структурными особенностями на 79,6% [116,117]. Титры антител обнаруживаются в течение 1-2 недель после появления симптомов у большинства инфицированных лиц [118]. Особенно IgM и IgA против SARS-CoV-2 были обнаружены в течение 1-й недели заражения, тогда как антитела IgG были обнаружены примерно на 14-й день после появления симптомов [119-122]. Недавние исследования показывают, что нейтрализующие антитела тесно коррелировали с тяжестью заболевания у пациентов с COVID-19 [123], и высокие титры антител исчезали в течение нескольких недель после заражения [124]. Кроме того было выявлено, что и сам титр антител у бессимптомных лиц снижался быстрее и оставался ниже, чем у лиц с симптомами [125]. В случае SARS-CoV длительное, специфическое носительство IgG и нейтрализующих антител сохраняются в течение 2 лет после заражения [126], тогда как нейтрализующие антитела к БВРС-КоВ были обнаружены в течение 14-21 дней от начала заболевания [127]. Нет корреляции между защитой от SARS-CoV-2 и других коронавирусов, и неизвестно, какие титры нейтрализующих антител необходимы для обеспечения полной защиты [128]. Установление таких корреляций может помочь получить информативную информацию о вакцинации против COVID-19.
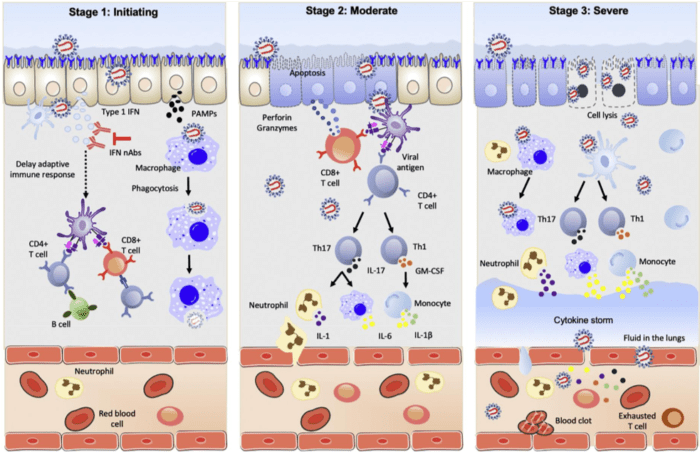
Рис. 3. Иммунный ответ на SARS-CoV-2 на разных патологических стадиях. На стадии 1 в полости носа SARS-CoV-2 связывается с рецепторами ACE2 на эпителиальных клетках с помощью белка S, проникает в клетку,и начинает реплицировать. Вирус размножается и одновременно распространяется по дыхательным путям, в это же время и начинают появляться клинические проявления и симптомы. При заражении вирус активирует продукцию интерферонов типа I. У пациентов с COVID-19 выработка интерферонов типа I задерживается самим SARS-CoV-2, что снижает адаптивный иммунный ответ. Врожденная иммунная система хозяина выявляет SARS-CoV-2 посредством распознавания ассоциированных с патогенами молекулярных паттернов (PAMP) альвеолярными макрофагами, активирующими цитокины, такие как IL-6 и TNF-α, приводящий к фагоцитозу или активации вируса. На стадии 2 инфицированные эпителиальные клетки представляют вирусные антигены как к CD4+так и к CD8+Т-клеткам. CD8+Т-клетки выделяют перфорины и гранзимы, которые вызывают апоптоз инфицированных клеток. CD4+Т-клетки быстро активируются, превращаясь в клетки Th1, которые секретируют GM-CSF и дополнительно индуцируют моноциты за счет высоких уровней IL-6. Увеличение субпопуляции моноцитов способствует развитию производства ИЛ-1β. Клетки Th17 продуцируют IL-17 для дальнейшего рекрутирования моноцитов, макрофагов и нейтрофилов и стимулируют образование других воспалительных цитокинов, таких как IL-6, IL-1 и IL-1β. На этапе 3 воспалительные клетки высвобождают дополнительные цитокины, которые усиливают цитокиновый шторм и усугубляет системныйвоспалительный ответ, в конечном итоге приводящий к ОРДС, полиорганной недостаточности и смерти.
4. Варианты невакцинального лечения COVID-19
Сходства, обнаруженные между SARS-CoV-2, SARS-CoV и MERS-CoV, привели к быстрому пониманию его патологии [129], и текущие усилия сосредоточены на ускорении разработки терапевтических средств от COVID-19 путем перепрофилирования уже клинически доступных лекарств, внедрения новых технологий или укрепления иммунной системы [130]. Переназначение противовирусных препаратов, одобренных FDA или находящихся в настоящее время на исследованиях для лечения других вирусных инфекций, было популярным подходом к разработке терапии COVID-19 для более ускоренного их внедрения в практику [131], и недавно Веклури (ремдесивир) стал первым препаратом, одобренным FDA для лечения COVID-19, за которым последовало первое разрешение на экстренное использование (EUA) моноклональных антител.
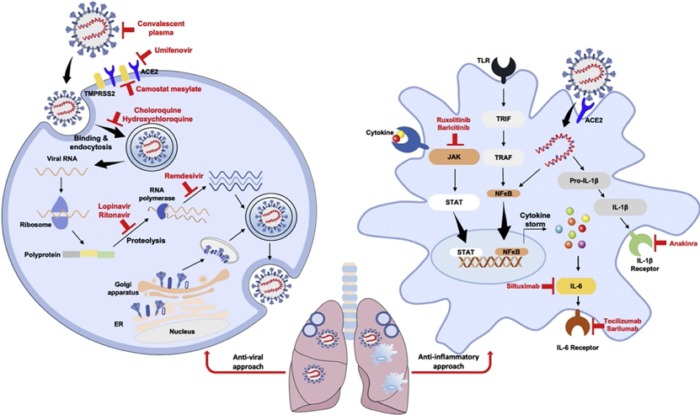
Рис. 4. Схематическое изображение инфекции SARS-CoV-2 и сигнальных путей как потенциальных мишеней для лечения. SARS-CoV-2 связывается с рецепторами ACE2 и TMPRSS2 через Sбелок, приводящий к слиянию вирусной мембраны с хозяином. Умифеновир и Мезилат камостата подавляют процесс проникновения вируса. Вирус проникает в клетки путем эндоцитоза, а хлорохин и гидроксихлорохин ингибируют эндосомальноезакисление и препятствуют гликозилированию ACE2. Вирусная РНК высвобождается и транслируется в основные вирусные полипротеины, 3CLpro и PLpro. Лопинавир / ритонавир подавляет активность 3CLpro. Для репликации вируса требуется РНК-полимераза, и ремдезивир включается в формирующуюся вирусную РНК, вызывая остановку синтеза РНК и предотвращая репликацию вируса. Инфекция SARS-CoV-2 вызывает массовый выброс цитокинов, включая IL6, IL-1β, и IL-1 и увеличивает активацию NF-κB и JAK-STAT сигнальных путей. Тоцилизумаб и сарилумаб связываются с мембранными и растворимыми рецепторами IL-6, подавляя сигнальный путь JAK-STAT и ослабляя воспалительные процессы. Барицитиниб и руксолитиниб подавляют киназную активность JAK1 и JAK2, а анакинра, антагонист рецептора IL-1, снижает «гипервоспаление» и респираторный дистресс.
Бамланивимаба и казиримаба/имдевимаба (Таблица 1). Противовирусные и химиотерапевтические средства, используемые в текущей клинической практике, прошли испытания на то, как они воздействуют непосредственно на COVID-19, ограничивая репликацию вируса в клетках-хозяевах. Другой подход направлен на то, чтобы модулировать усиление реактивности иммунной системы с помощью клеточной терапии и лечения плазмой выздоравливающих или ингибирования протовоспалительного процесса, ассоциированного с цитокиновым штормам (Рис. 4). Эти методы лечения нацелены на снижение бремени SARS-CoV-2 у пациентов, облегчение тяжелых симптомов и замедление прогрессирования COVID-19 [132].
4.1. Ингибиторы РНК-полимеразы
Ремдесивир, первоначально разработанный для лечения инфекций Эбола, был первым противовирусным препаратом, одобренным FDA для терапии COVID-19 на22 октября 2020 г. [133,134]. Это лекарственный препарат, который ранее проявлял противовирусную активность против SARS-CoV и MERS-CoV, он останавливает синтез РНК и подавляет репликацию генома SARS-CoV-2 [135,136]. Клинические испытания ремдесивира в рандомизированных плацебо-контролируемых группах лечения с участием 1062 пациентов улучшало время выздоровления некоторых пациентов с COVID-19 на поздних стадиях [137]. Фавипиравир, аналог гуанина, ингибирует РНК-полимеразу и в настоящее время используется длялечения ОРВИ [138]. Комбинация фавипиравира и интерферона-α(ChiCTR2000029600) или балоксавир марбоксил (ChiCTR2000029544) показали активность против SARS-CoV в клетках Vero E6, и рандомизированные клинические испытания для оценки их безопасности и эффективности в настоящее время продолжаются[139]. Другие противовирусные препараты, которые в настоящее время используются для лечения COVID-19, включают ингибитор нейраминидазы осельтамивир. Осельтамивир использовался для лечения гриппа A и B, поскольку им требуется нейраминидазадля высвобождения вируса в клетки-хозяева. SARS-CoV-2 не экспрессирует нейраминидазу, поэтому комбинированная терапия осельтамивиром вместе с ингибиторами протеаз эффективна для терапии COVID-19 [140,141].


4.2. Ингибиторы протеазы
Лопинавир (LPV) и ритонавир (RTV) являются ингибиторами протеазы, одобренными для лечения инфекции ВИЧ-1 [142]. Из-за его низкой пероральной биодоступности LPV входит в состав RTV для повышения растворимости лекарственного средства и улучшения противовирусной активности [142]. Первоначально предполагалось, что LPV и RTV ингибируют 3-химотрипсин-подобную протеазу SARS-CoV и MERS-CoV, что предполагает их потенциальное использование для лечения COVID-19 [143,144]. LPV и RTV использовались в качестве тройной комбинированной терапии с PEG-IFN-α и рибавирином [145] или хлорохином/ гидроксихлорохином при лечении COVID-19 [146]. Некоторые клинические испытания показали, что LPV / RTV не ингибирует протеазы SARS-CoV-2 (ChiCTR20000 29308). Другими ингибиторами протеазы, перепрофилированными для клинических испытаний COVID-19, являются RTV в сочетании с ASC09 и дарунавиром, противовирусным препаратом, предназначенным для лечения ВИЧ / СПИДа (NCT04261907)
4.3. Ингибиторы слияния вирусов и клеток
SARS-CoV-2 использует рецептор ACE2, еще одну частую мишень в клинических испытаниях COVID-19 [147], для того, чтобы инфицировать клетку-хозяина. Недавнее исследование in vitro показало, что растворимый человеческий рекомбинантный ACE2 (hrsACE2) резко снижает нагрузку SARS-CoV-2 в клетках линииVero дозозависимым образом [148]. Арбидол, также известный как умифеновир, блокирует слияние вирусной мембраны с клеточной мембраной, а также слияние вирусной мембраны с эндосомой после эндоцитоза [149]. Например, в вирусегриппа H1N1, он напрямую взаимодействует с вирусом для стабилизации гемагглютинина (НА) [150]. При SARS-CoV-2 умифеновир препятствовал связыванию вируса и перемещению внутриклеточных пузырьков в клетках линии Vero E6 [149], а также рассматривается как терапия COVID-19 в сочетании с ингибиторами протеазы [151].
Хорошо известные противомалярийные и противоаутоиммунные агенты, хлорохин и гидроксихлорохин блокируют вирусную инфекцию за счет увеличения эндосомального pH для подавления слияния мембран между вирусом и клетками человека-хозяина [152,153]. Гидроксихлорохин, производное хлорохина, имеет фармакокинетические эффекты, аналогичные хлорохину, с меньшим количеством побочных эффектов [154]. Лечение гидроксихлорохином показало исчезновение вирусов у пациентов с COVID-19, а комбинированная терапия азитромицином усиливала противовирусный эффект [155]. Кроме того, ряд клинических испытаний в Китае показал предельную терапевтическую эффективность идейственность гидроксихлорохина у пациентов с пневмонией, вызванной COVID-19 [156]. Тем не менее, FDA предостерегает против использования хлорохина / гидроксихлорохина у амбулаторных пациентов из-за серьезных рисков аритмии у пациентов с COVID-19 с артериальной гипертензией, сердечной недостаточностью и хроническими заболеваниями почек в анамнезе, отклонив одобрение данного типа терапии COVID-19. [157]. Лечение хлорохином показало специфическое ингибирование репликации SARS-CoV путем вмешательства в гликозилирование рецептора ACE2 [153], эффективно уменьшая количество копий SARS-CoV-2 [158]. Интересно, что ингибиторы рецепторов ACE2, как уже было показано, увеличивают экспрессию рецепторов ACE2, что приводит к усилению проникновения вирусов, ограничивая их клиническую активность [159].
4.4. Анти-воспалительные агенты
Несколько иммуномодулирующих препаратов, модифицирующих силу и выраженность воспалительной реакции, проверяются на их эффективность в лечении тяжелых форм COVID-19 [160]. Цитокиновый шторм является критическим фактором смертности у пациентов с серьезными симптомами на поздней стадии COVID-19 [103]. Ил-6 — ключевойвоспалительный цитокин, уровни которого значительно повышены у тяжелобольных пациентов с COVID-19 [76,161], а сигнальный путь рецептора IL6 / IL-6 (IL-6R) является перспективной мишенью для облегчении воспалительных симптомов. Тоцилизумаб, гуманизированное антитело против рецептора IL-6, одобренное для использования при ревматоидном артрите [162],продемонстрировало эффективность против синдрома высвобождения цитокинов, связанного с терапией CAR-T-клетками [163]. Тоцилизумаб связывается как с мембранными рецепторами, так и с растворимыми рецепторами IL-6, подавляя сигнальный путь JAK-STAT и блокируя нисходящий путь образования воспалительных молекул[164]. Прием тоцилизумаба показал быстрое, в течениенесколько дней, улучшение респираторной функции у пациентов с COVID-19 [164]. Сарилумаб, другой блокатор рецепторов IL-6, который также ингибирует сигнальный путь IL-6. В настоящее время проводятся клинические испытания для оценки его безопасности и эффективности у пациентов COVID-19 с серьезными осложнениями [165]. Ингибирование путей JAK-STAT с использованием ингибиторов JAK, одобренных для лечения ревматоидного артрита и псориатического артрита, является еще одним потенциальным иммунотерапевтическим подходом к облегчению цитокинового шторма при COVID-19 [166]. Барицитиниб подавляет киназную активность JAK1 и JAK2 и эффективно подавляет вирусную инфекцию SARS-CoV-2 [167]. А ритуксолитиниб, другой ингибитор JAK1 и JAK2, демонстрирует некоторую эффективность в купировании тяжести симтомов респираторного дистресс-синдрома [168]. Сообщалось, что уровень IL-1 повышен у некоторых пациентов с COVID-19 [5] и блокирование ИЛ-1 с помощью Анакинры, антагониста рецепторов ИЛ-1, ранее одобренного для лечения ревматоидного артрита, показало многообещающие результаты в снижении «гипервоспаления» и респираторного дистресс-синдрома у пациентов с COVID-19 (NCT04324021).
Применение кортикостероидовпредставляется полезным по данным метаанализа семи рандомизированных клинических исследований, в которых участвовали 1703 пациента, набранных с 5 разных континентов [169]. Стероиды дешевы, легкодоступны и эффективны в снижении смертности наиболее серьезно пострадавших пациентов с COVID-19 [169]. Декса-метазон, противовоспалительный препарат, обладает антифибротическим и сосудосуживающим действиями [170] и многие клинические испытания, проведенные за последнее десятилетие, подтвердили его эффективность в лечении пневмонии, сепсиса или ОРДС [171]. У пациентов с ОРДС кортикостероиды улучшали насыщение кислородом и снижали воспаление [172]. Поскольку недавнее исследование показало, что дексаметазон снижает смертность пациентов с COVID-19, находящихся на ИВЛ на треть [173], стероиды были предложены в качестве потенциальных лекарств от COVID-19, благодаря их способности смягчатьвоспаление и другие негативные реакции иммунной системы [174]. Несмотря на явную пользу от усмирения цитокинового шторма, подавление воспаления и выраженности иммунного ответа, эти препараты, действуя таким образом, могут стать препятствием к избавлению от вирусов.
4.5. Клеточная иммунотерапия
Натуральные киллеры (NK) являются врожденными иммунными респондерами и имеют решающее значение для очистки человеческого организма от вирусов и регуляции всей иммунологической активности в целом. В дополнение к их противовирусной активности, NK-клетки также играют ключевую иммунопатологическую роль во время инфекций RSV (респираторно-синцитиальный вирус), гриппа типа A и вируса гепатита B [175]. Предыдущие исследования показало, что миграция NK-клеток и макрофагов помогала избавляться от SARS-CoV [176], а NK-клетки от пациентов с COVID-19 демонстрировали повышенный уровень белка-перфорина, что дает основу для понимания роли NK-клеток в противостоянии COVID-19 [177]. Учитывая важность NK-клеток в подавлении острой вирусной инфекции, недавние исследования продемонстрировали потенциальные стратегии иммунотерапии на основе NK-клеток при COVID-19 [178]. Текущее клиническое исследование в Китае изучает использование NK-клеток для удаления вируса у пациентов с тяжелой пневмонией, связанной с COVID-19 (NCT04280224). Самообновляющиеся, мультипотентные мезенхимальные стволовые клетки (МСК) с их значительными противовоспалительными способностями, также играют важную роль в течении воспалительных заболеваний [179]. Было показано, что МСК помогают облегчить цитокиновый шторм, восстановить повреждение легочного эпителия и облегчить очищение альвеолярной жидкости [180]. Исследования на животных с использованием МСК продемонстрировали эрадикацию с их участием вируса гриппа A,штамм H5N1,при исходном остром вирусном повреждении легких [181]. Несколько клинических испытаний фазы I и II подтвердили безопасность и эффективность терапии МСК для пациентов с ОРДС [182,183].
4.6. Моноклональные антитела и терапия донорской плазмой от выздоравливающих
Опосредованный антителами гуморальный иммунитет имеет решающее значение для предотвращения повторных вирусных инфекций, а нейтрализующие антитела являются специфическими и эффективны для таргетирования вируса. Этот классический подход адаптивной профилактики применялся ко многим инфекционным заболеваниям, включая SARS-CoV, MERS-CoV и инфекции H1N1 [184]. Белок SARS-CoV-2 S является основным индуктором нейтрализующих антител и моноклональных антител. Бамланивимаб [185], касиривимаб и имдевимаб [186] были одобрены FDA в ноябре 2020 г в качестве ургентных показаний. Другие моноклональные антитела против S-белка также включают 80R [187], CR3014 [188], CR3022 [189] и m396 [190] и находятся в стадии разработки. CR3022 в настоящее время тестируется на степень аффинности к RBD белку SARS-CoV-2 S и продемонстрировал его нейтрализацию с помощью комбинированной терапии CR3014 [189], а 80R и m396 также показали мощную перекрестную нейтрализацию при SARS-CoV [190]. Четыре исходных человеческих моноклональных антитела (B5, B38, H2 и H4) от выздоравливающего пациента показали связывание с SARS-CoV-2 RBD, что приводило к высокому уровню нейтрализации вируса [190-192]. Некоторые исследования показали более низкий уровень смертности среди пациентов, получавших плазму выздоравливающих, по сравнению с плацебо [193]. Однако лечение плазмой реконвалесцетов ограничено, так как терапию необходимо продлевать, в то же время наблюдались побочные эффекты, включая умеренную лихорадку и аллергические реакции [194].
5. Вакцины против COVID-19
5.1. Стратегия вакцинации
С марта 2020 года мир находится в условиях разного рода изоляции, что приводит к серьезным экономическим и социальным последствиям. Кроме того, несмотря на использование масок и других протоколов безопасности, большое количество человеческих жизней было потеряно из-за инфекции COVID-19. COVID-19 быстро и внезапно распространился по всему миру, и миллионы людей во всем мире уже подверглись заражению. По некоторым оценкам, от 1 до 20% населения планеты подверглись воздействию COVID-19; однако эти оценки сомнительны, так как многие пациенты не имеют симптомов и не проходят обследование [16]. В то время как целый ряд стран централизованно рассматривают возможность медленного и преднамеренного заражения всего населения, что-то вроде вечеринок с ветряной оспой в 1980 году, однако даже это необходимосделать безопасно, не перегружая больницы, и на это уйдут годы [95]. Кроме того, SARS-CoV-2 гораздо опаснее ветряной оспы или гриппа, и, как было показано, оказывает долгосрочное воздействие на легкие, сердце и центральную нервную систему, которые до сих пор полностью не изучены [195]. Вакцина остро необходима не только для индивидуального здравоохранения, но и для формирования коллективного иммунитета, для достижения которого необходимо вакцинировать не менее 70% всего населения [196]. К сожалению, иммунный ответ на патоген часто бывает неоднородным и варьируется у разных людей в зависимости от возраста, влияния факторов окружающей среды и состояния общественного здоровья вцелом [197,198]. В то время как вакцины эффективно способствуют достижению коллективного иммунитета, шансы на новые вспышки и уже сейчас четко различимое рецидивирующее течение данного инфекционного заболевания [199] требует возможности медицинского вмешательства и назначения специфичной комбинированной терапии. Профилактическая вакцинация — это самый безопасный и экономически эффективный способ предотвратить заболеваемость и смертность от COVID-19, а также лучший вариант для борьбы с ожидаемыми в будущем ее генетическими вариациями. Ежегодно CDC проводит наблюдение за, например, циркулирующими штаммами вируса гриппа и вносит коррекции, с учетом результатов использования противогриппозных вакцин против наиболее распространенных штаммов [200]. Аналогичная глобальная стратегия необходима для предотвращения или минимизации распространенности COVID-19 и будущих вариантов SARS-CoV-2.
5.2. Иммунитет, генерируемый вакцинами COVID-19
Вакцины против COVID-19 представлены тремя широко классифицированными формами молекулярных, в частности и клеточных вакцин, преследующих одну и ту же цель — стимулировать иммунную систему вырабатывать эндогенные антитела против SARS-CoV-2 с образованием клеток памяти. Молекулярные вакцины используют цельные белки, фрагментированные пептиды или цельные вирусы и вызывают иммунный ответ с помощью антигенпрезентирующих клеток (APC), таких как дендритные клетки, DC [201]. В частности, DC играют ключевую роль в захвате молекул, фрагментации их на более мелкие пептиды и презентации антигенных пептидов на MHC I и II (или HLA у людей) для праймирования Т-клеток и инициации клеточногопротивовирусного иммунитета [202]. Презентация антигена MHC I вместе с костимулирующими поверхностными молекулами, такими как CD80 и CD86 на дендритных клетках, приводит к активации CD8+Т-клеток. CD4+ Т-клетки могут как стимулировать В-клетки к выработке нейтрализующих антител, так и дополнительно способствовать активации цитотоксических лимфоцитов [203]. Вирусы и инфицированные вирусом клетки быстроузнаются и уничтожаются активированным иммунитетом, инициируемым антигенпрезентирующими клетками в сотрудничестве с Т-клетками и другими иммунными клетками.
Большинство вирусных вакцин в первую очередь нацелены на формирование опосредованного антителами иммунного ответа, и новые данные о Т-клеточном иммунитете у пациентов с COVID-19 могут помочь в разработке стратегий эффективной защиты от SARS-CoV-2 [204]. Память CD4+ Т и CD8+ Т-клеток, праймированных против белков S, N и M, была обнаружена у 100% и 70% выздоровевших пациентов с COVID-19 соответственно [205,206], тогда как иммунизация представляющими пептид SARS-CoV ДК, вызывала образование большего количества вирусспецифичных CD4+Т и CD8+ Т-клетки и статистически значимо повышала общую выживаемость [207]. Хотя Т-клетки важны для эффективной вакцинации несколько вакцин против SARS-CoV показали не столько защиту, сколько усиление иммунопатологических признаков [208,209], что требует дальнейших исследований Т-клеточного иммунитета путем вакцинации против COVID-19.
Нейтрализующие ответы антител против S и N белков SARS-CoV-2 были обнаружены у большинства пациентов в течение 3 недель [210]. Однако недавние исследования показали, что CD4+ Т-клетки здоровых людей, которые не подвергались воздействию SARS-CoV-2, также распознавали белки SARS-CoV-2, вызывая опасения, что ранее существовавший иммунитет, возможно, способствовал антителозависимому усилению (ADE) [211], следовательно, снижение стимуляции В-клеток. ADE представляет собой потенциальную проблему при разработке эффективной вакцины против COVID-19, особенно за счет усиления опосредованного Т-клетками иммунитета. Когда харьков вакцинировали модифицированной вакциной Анкары (MVA), конечно же наблюдалась экспрессия белка S, но и увеличивалась степень инфицирования вирусом [212] и к сожалению имело место индуцированное повреждение легких [213].
Сокращения: APC, антигенпрезентирующая клетка; DC, DC дендритных клеток; AD, аденовирус; AD, AAV, аденоассоциированный вирус; LNP, липидные наночастицы; COVID-19, коронавирусная болезнь 2019; ОРДС, острый респираторный дистресс-синдром; SARS-CoV-2, тяжелый острый респираторный синдром, коронавирус 2; ОРВИ, тяжелый острый респираторный синдром, коронавирус; MERS, коронавирус респираторного синдрома Ближнего Востока; CDC, Центры по контролю и профилактике заболеваний; ВОЗ, Всемирная организация здравоохранения; FDA, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США; EUA, разрешение на использование в чрезвычайных ситуациях; ACE2, ангиотензин-превращающий фермент 2; TMPRSS2, серин трансмембранной протеазы; S-белок, шипованный белок; N-белок, нуклеокапсидный белок; Белок E, белок оболочки; М-белок, мембранный белок; RBD, рецептор-связывающий домен; NTD, N-концевой связывающий домен; PPR, рецепторы распознавания образов; Клетка NK, естественная клетка-убийца; RSV, респираторно-синцитиальный вирус; МСК, мезенхимальные стволовые клетки; CTL, цитотоксические Т-лимфоциты; ADE, антитело-зависимое усиление; Интерфероны типа 1, интерфероны типа 1; Толл-подобный рецептор, TLR.
перевёл Артём Машуков

