Вакцины против Covid-19. Научный подход. Эксклюзив
11.09.2021Стратегия вакцинации
С марта 2020 года мир находится в различных условиях изоляции, что приводит к серьезным экономическим и социальным последствиям. Кроме того, несмотря на использование масок и других протоколов безопасности, из-за COVID-19 погибло несколько человек. COVID-19 быстро и неожиданно распространился по всему миру, и миллионы людей во всем мире уже подверглись заражению. По некоторым оценкам, от 1 до 20% населения подверглись воздействию COVID-19; однако эти оценки сомнительны, так как многие пациенты не имеют симптомов и не проходят обследование [16]. В то время как несколько стран рассматривают возможность медленного и преднамеренного заражения, что-то вроде вечеринок с ветряной оспой в 1980 году.’s, это нужно делать безопасно, не перегружая больницы, и на это уйдут годы [95]. Кроме того, SARS-CoV-2 гораздо опаснее ветряной оспы или ветряной оспы.этuenza, и было показано, что они оказывают долгосрочное воздействие на легкие, сердце и центральную нервную систему, которые до сих пор полностью не изучены [195]. Вакцина остро необходима не только для индивидуального здравоохранения, но и для достижения коллективного иммунитета, при котором необходимо вакцинировать не менее 70% всего населения [196]. К сожалению, иммунный ответ на патоген часто бывает неоднородным и варьируется у разных людей в зависимости от возраста, окружающей среды и основных состояний здоровья [197,198]. В то время как вакцины, эффективно генерирующие специфическиефиc и контролируемые ответы могут способствовать достижению коллективного иммунитета, шансов на инфекции и рецидивирующие инфекции SARS-CoV-2 [199] требуют терапевтических вмешательств и комбинированной терапии. Профилактическая вакцинация — это самый безопасный и экономически эффективный способ предотвратить болезнь и смерть от COVID-19, а также лучший вариант для борьбы с ожидаемыми в будущем вариантами. Ежегодно Центр контроля заболеваний проводит наблюдение за циркулирующими штаммами животных.этuenza virus и настраивает протоколы для повторногоэтect the фирезультаты в приготовлении вакцин против наиболее распространенных штаммов в наступающем году [200]. Аналогичная глобальная стратегия необходима для предотвращения или минимизации распространенности COVID-19 и будущих вариантов SARS-CoV-2.
Иммунитет, создаваемый вакцинами COVID-19
Вакцины против COVID-19 представлены тремя широко классифицированными формами молекулярных, в частности и клеточных вакцин, преследующих одну и ту же цель — стимулировать иммунную систему против SARS-CoV-2 с образованием клеток памяти. Молекулярные вакцины используют цельные белки, фрагментированные пептиды или цельные вирусы и вызывают иммунный ответ с помощью антигенпрезентирующих клеток (APC), таких как DC [201]. В частности, DC играют ключевую роль в захвате молекул, фрагментации их на более мелкие пептиды и презентации антигенных пептидов на их MHC I и II (или HLA у людей) для примирования Т-клеток для инициации клеточного и человеческого иммунитета против вирус [202]. Презентация антигена MHC I вместе с костимулирующими поверхностными молекулами, такими как CD80 и CD86 на DC, приводит к CD8+Активация Т-клеток. Презентация антигена MHC II простые CD4+ Т-клетки, которые могут как стимулировать В-клетки к выработке нейтрализующих антител против патогена, так и дополнительно способствовать активации ЦТЛ [203]. Большинство вирусных вакцин в первую очередь нацелены на формирование опосредованного антителами иммунного ответа, и новые данные о Т-клеточном иммунитете у пациентов с COVID-19 могут помочь в разработке стратегий эффективной защиты от SARS-CoV-2 [204]. Память CD4+ Т и CD8+ Т-клетки, примированные против белков S, N и M, были обнаружены у 100% и 70% выздоровевших пациентов с COVID-19 соответственно [205,206], тогда как иммунизация ДК, представляющими пептид SARS-CoV, генерировала большее количество вирусспецифичныхфиc CD4+ Т и CD8+ Т-клетки и повышение общей выживаемости [207]. Хотя Т-клетки важны для эффиПри вакцинации несколько вакцин против SARS-CoV показали усиление иммунопатологических признаков, а не защиту [208,209], что требует дальнейших исследований Т-клеточного иммунитета путем вакцинации против COVID-19.
Нейтрализующие ответы антител против S и N белков SARS-CoV-2 были обнаружены у большинства пациентов в течение 3 недель [210]. Однако недавние исследования показали, что CD4+ Т-клетки здоровых людей, которые не подвергались воздействию SARS-CoV-2, также распознавали белки SARS-CoV-2, вызывая опасения, что ранее существовавший иммунитет, возможно, способствовал антителозависимому усилению (ADE) [211], следовательно, снижение стимуляции В-клеток. ADE представляет собой потенциальную проблему при разработке эффективной вакцины против COVID-19, особенно за счет усиления опосредованного Т-клетками иммунитета. Когда хорьков вакцинировали модификациямифивакцина против осповакцины Анкары (MVA), которая экспрессировала белок SARS-CoV S, увеличивала инфицирование вирусом [212] наряду с антителами против белка S и индуцированное повреждение легких наблюдались в связи с ADE [213].
Соображения при разработке и применении вакцины против COVID-19
Эффективные и безопасные вакцины против COVID-19 должны будут генерировать желаемый гуморальный и клеточный иммунитет против SARS-CoV-2, одновременно сводя к минимуму неблагоприятные побочные эффекты, такие как цитокиновые бури, а также быть достаточно пластичными, чтобы обеспечивать быстрое внедрение и модификацию, особенно в отношении ожидаемых вирусных мутаций. Следовательно, необходимо рассмотреть вопрос о выборе подходящего антигена, составах, путях введения и времени вакцинации.
Выбор антигена для желаемого иммунного ответа
Независимо от платформы вакцинации, выбор наиболее мощного целевого антигена (ов) имеет решающее значение при разработке эффективных вакцин против COVID-19 [214,215]. Идеальные антигены должны быть специфичными к SARS-CoV-2 и легко распознаваться иммунной системой (Рис. 5).
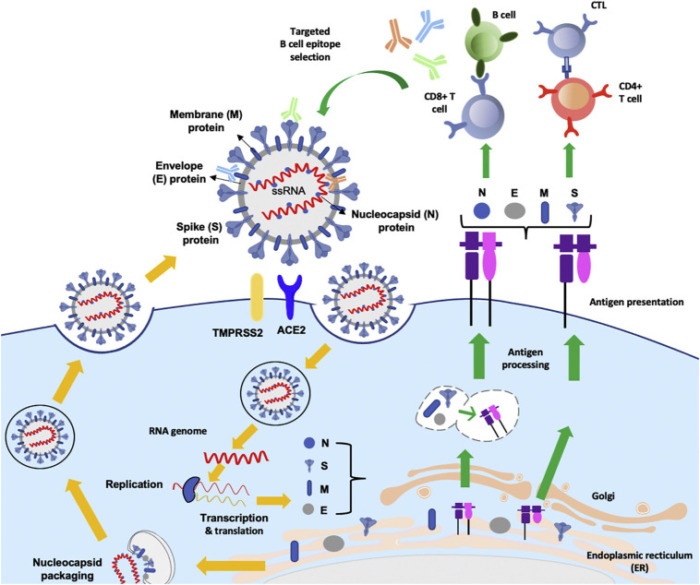
Структура SARS-COV-2, инфицирование и внутриклеточная сборка. SARS-CoV-2 связывается с ACE2 и TMPRSS на поверхности эпителиальных клеток через белок S, который опосредует слияние вирус-клеточной мембраны и обеспечивает проникновение. Вирусная геномная РНК высвобождается и транслируется в белки вирусной полимеразы. Вирусная РНК реплицируется и обратно транскрибируется в цитоплазме, а транскрибированные и транслируемые вирусные белки транспортируются в эндоплазматический ретикулум (ER) и комплекс Гольджи. Белки S, E и M собираются в компартменте ER-Golgi-комплекс и образуют зрелый вирион. Белок N собирается со зрелым вирионом, и на финальной стадии выделяется целый вирус. Белки S, E, M и N расщепляются на пептиды, а вирусные антигены, как показано в правом верхнем углу, представлены MHC I и II на CD8 + T и CD 4+ T-клетках, соответственно, для индукции клеточного и гуморального иммунитета.
Производство антител. RBD компонен S протеина является основной мишенью для нейтрализации опосредованной антителами инактивации SARS-CoV-2 для предотвращения проникновения вируса в клетки-хозяина путем блокирования связывания вируса с рецепторами ACE2, ограничения его внедрения и распространения. Антитела, вырабатываемые вакциной COVID-19, должны не только связываться с SARS-CoV-2, но и нейтрализовать вирусные функции, избегая при этом возможности проникновения вируса с помощью ADE, как это наблюдается у пациентов с SARS [216]. Подобно белку SARS-CoV S, который генерировал нейтрализующие антитела в экспериментальных моделях у мышей [55,217], плазма выздоровевших от с SARS-CoV-2 пациентов содержала специфические нейтрализующие антитела к белку S (полноразмерные S, S1, RBD и S2) [114,218,219]. Следовательно, в большинстве вакцин против COVID-19 почти исключительно используется антиген SARS-CoV-2 S, склонный к мутации [119], включая G614 и D614 [35], безотносительно к текущим клиническим сценариям. Хотя мутация G614 чувствительна к нейтрализации в сыворотке выздоравливающих, она кажется более заразной, чем мутация D614 [220,221]. Белок S сильно гликозилирован и его модифицированные участки гликозилирования были исследованы для оценки инфекционности и реактивности по отношению к нейтрализующим антителам [119]. Например, делеция сильно гликозилированных остатков, таких как N331 и N343, снизила инфекционность SARS-CoV-2 и других модификаций в RBD, A475V, L452R, V483A и F490L, что привело к устойчивости к нейтрализующим антителам [119]. Наблюдение, что преформированный стабилизированный S-белок генерировал больше нейтрализующих антител, чем нативный S-тример, привело к множеству кандидатов на вакцину против SARS-CoV-2 [222,223]. Субъединица RBD также была исследована как многообещающий эпитоп для продуцирования S-антиген-специфичного нейтрализующие антитела [113]. Среди различных субъединиц S-белка, включая S1, субъединицу RBD, S2 и модифицированные варианты, субъединица RBD вырабатывала наиболее высокие уровни нейтрализующих антитела в моделях у кроликов [224]. Кроме того, RBD-модифицированный SARS-CoV-2 вызывал сильную реакцию выработки антител у крыс [225].
Активация Т-клеток. До сих пор генерация антител B-клетками была приоритетом большинства разработок вакцин против COVID-19, при этом мало внимания уделялось очищению от SARS-CoV-2 клеток с помощью клеточного иммунитета, опосредованного T-клетками, в координации с другими иммунными клетками. CD4+Т и CD8+Т-клетки специфичные к белкам S, N и M вируса SARS-CoV-2 можно найти как у пациентов, выздоровевших от COVID-19, так и у бессимптомных лиц [205]. Недавнее исследование направленное на выявление корреляции между нейтрализующими антителами и CD4+Т-клетками против белка S [206] предположило жизненно важную роль активации именно CD4+Т-клеток при совместной активности Т- и В-клеток против SARS-CoV-2. Механизм антительного ответа на белок N был детально охарактеризован у пациентов с SARS-CoV [226] и его инъекция также вызвала Т-клеточные ответы у BALB/c мышей [227]. Однако таргетирование белка N не привело к появлению иммунной защиты от SARS-CoV, что позволяет предположить что белок N может быть периферийной мишенью в усилении иммунитета Т-клеток. Подобно SARS-CoV и MERS-CoV, SARS-CoV-2 блокирует образование антиген-специфичных Т-клетки, чтобы избежать иммунного ответа [228]. И SARS-CoV, и MERS-CoV реплицируются в двойных мембранных везикулах, чтобы защитить свою вирусную РНК от разрушающих ферментов [229], также как и БВРС-КоВ подавляет гены, ответственные за механизм презентации антигена [230]. В то время как механизмы и результаты презентации антигена во время инфекции SARS-CoV-2 остаются неясными [41], по-прежнему важно рассмотреть возможность использования этих иммунологических путей для формирования многослойной защиты. В целом вакцины COVID-19 должны быть способны доставлять SARS-CoV-2 S протеин или пептидный антиген для стимуляции Т-клеток, сводя к минимуму доставку других фрагментов, которые не продемонстрировали помощь в создании защитного иммунитета.
Пути администрирования
Традиционно вакцины вводятся внутримышечно для более медленного высвобождения из внутримышечного депо и наилучшего представления антигенов антигенпрезентирующими клетками. Однако все больше данных свидетельствует о том, что резидентные Т-клетки памяти остаются в легочной ткани и дыхательных путях уже после эрадикации респираторной вирусной инфекции [112,231-233]. В мышиной модели гриппозной инфекции, адаптивный перенос Т-клеток иммунной легочной памяти продемонстрировал полное искоренение болезни в течение 8 дней после инфицирования, в то время как животные, которым те же самые Т-клетки памяти перенесли в селезенку, умерли от болезни [234]. В других исследованиях назальная или внутримышечная вакцинация против вируса гриппа [235] или ДНК RSV [236,237] генерировала антиген-специфическую CD8+Т-клеточную память у мышей, при этом только назальная вакцинация производила синтез в тканях резидентных Т-клеток памяти, которые были способны защищать животное от вторичного воздействия. Для эффективной вакцинации против COVID-19 резидентные в легких Т-клетки памяти должны быть праймированы против SARS-CoV-2, поскольку именно они могут быть гораздо более эффективными, чем центральные и эффекторные Т-клетки памяти [238]. Таким образом, интраназальная ингаляция или ингаляция с использованием аэрозоля может быть преимущественным путем введения, обеспечивающий длительный иммунитет против SARS-CoV-2 [239]. Этот подход изучается для проработки интраназальной доставки одной из модификаций вакцины против COVID-19, созданной на основе аденовируса, на той же платформе, что и для вакцинации против вируса гриппа [240]. Подобные пути доставки могут быть легко применены к вирусным вакцинам и вакцинам на основе наночастиц, но сложны с точки зрения способа доставки вакцин, созданных на основе клеток.
Стоимость и доступность являются дополнительными важными факторами при определении путей введения вакцин COVID-19. Например, внутримышечные вакцинации обычно делаются профессиональными дистрибьютерами медицинских услуг в Соединенных Штатах, однако при этом обученный медицинский персонал доступен не во всех странах. Доступ к вакцинам во многом зависит от их компонентов, которые часто являются деликатными и требуют хранения в холодильниках или криотанках, что создает проблемы при транспортировке и распределении [241]. В ответ на эти проблемы была разработана пероральная вакцина на основе аденовируса для S-белка SARS-CoV-2, сочетающая преимущества использования иммунитета слизистых оболочек с простотой хранения и неинвазивным применением [242].
Продолжение тут
адаптировал Артём Машуков

